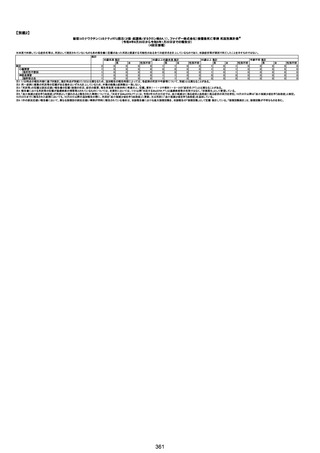
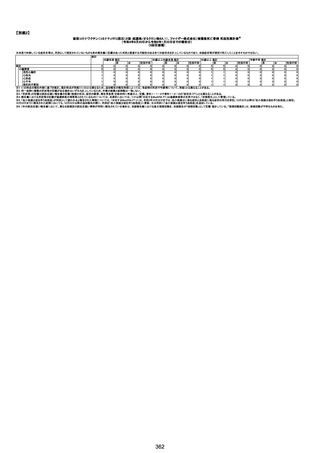
資料1-3-1 新型コロナワクチン接種後の死亡として報告された事例の概要(コミナティ筋注) (268 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
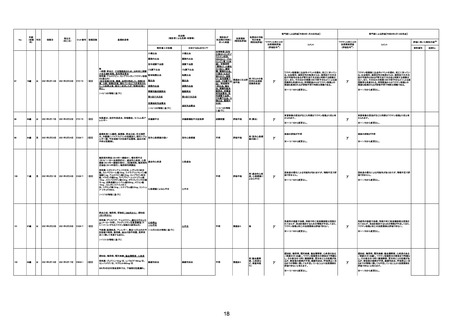
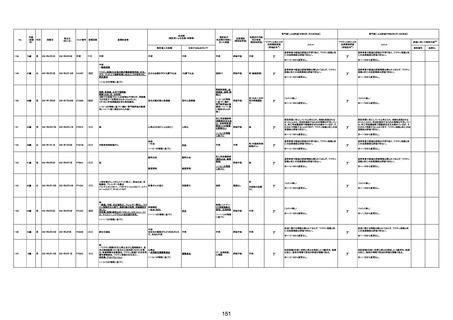
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
基礎疾患等
死因等
(報告者による見解・考察等)
報告書上の記載
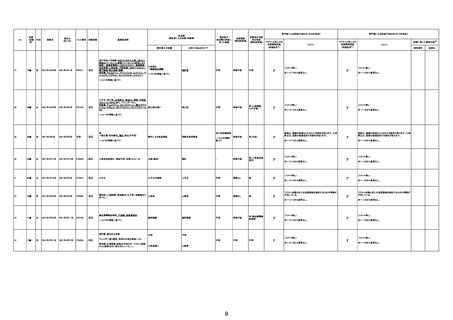
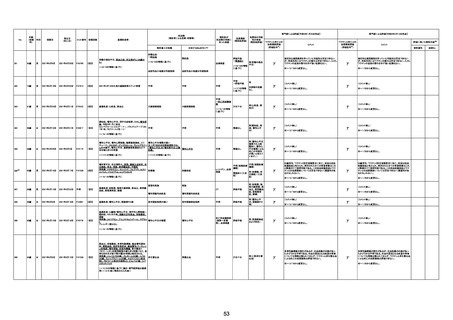
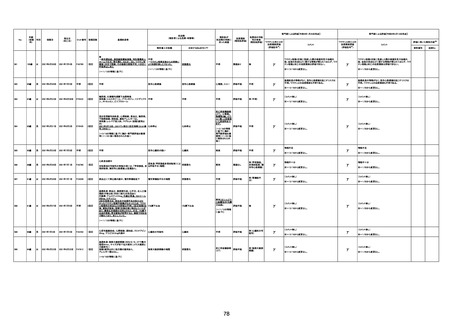
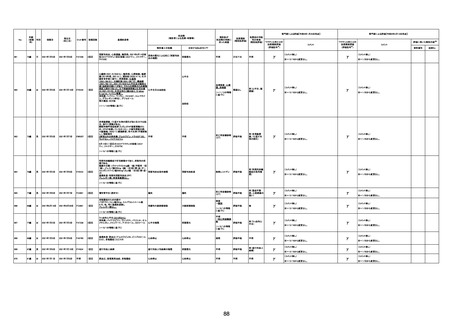
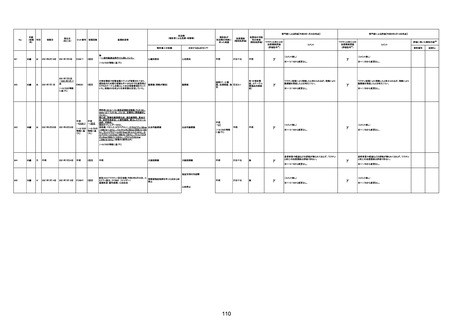
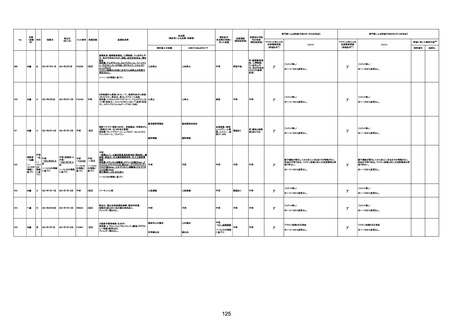
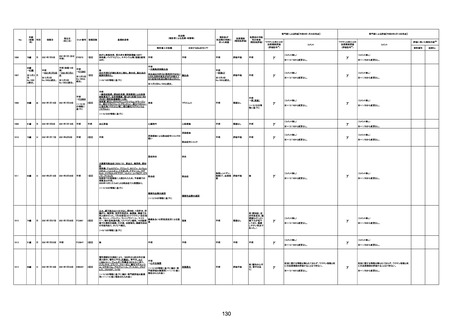
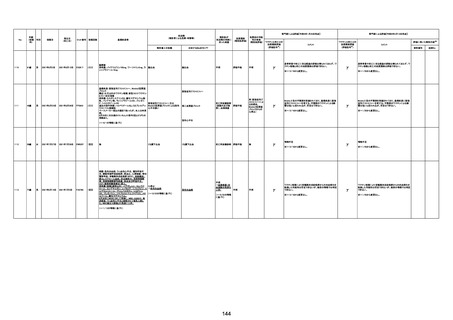
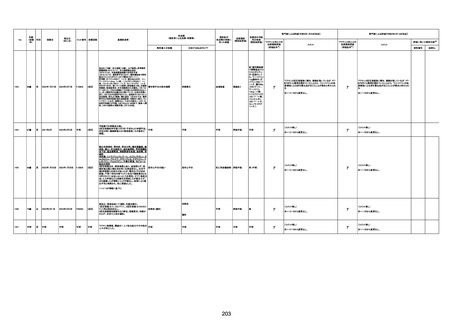
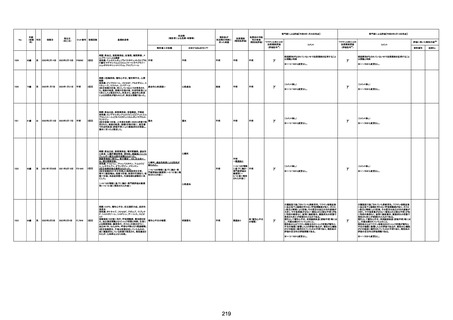
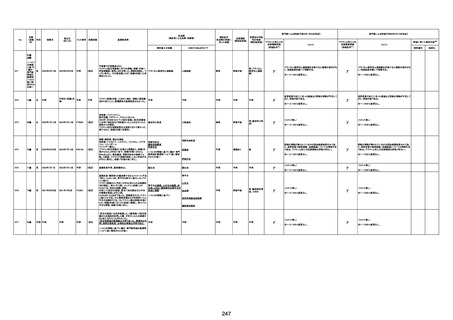
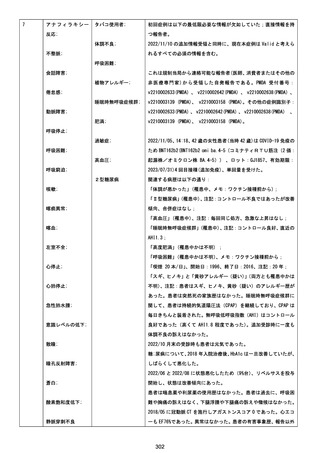
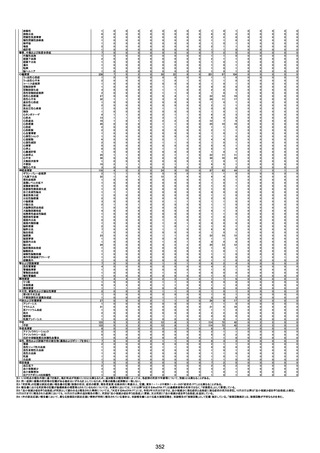
1790
73歳
女
2021年8月6日
2021年9月7日
FF0843
2回目
専門家による評価【令和5年1月20日時点】
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
基礎疾患等:腎疾患、肝炎
血小板減少症を伴う血栓症
20-30年前に腎疾患の病歴があった。肝炎に対して
も治療歴もあったが特に医療機関を受診していな
かった。
腎不全
2021/8/21 9:00過ぎ、家族は患者が横たわっている
ところを発見した。患者は最初は反応していたが、そ
の後反応を示さず、救急が要請された。救急隊が接
心筋炎
触をしたとき、心室細動の波形を示した。心肺蘇生 心筋炎、梗塞、心室細動、腎不全、
法(CPR)は病着の間実施された。無脈静電気活動 血栓症、血小板減少症を伴う血栓
(PEA)のため、経皮的心肺補助(PCPS)挿入し、心 症
梗塞
拍は再開した。補助循環から離脱できたが、敗血症
と急性腎不全の合併と蘇生後脳症のため、神経学
的予後は厳しいと判断した。徐々に腎不全は進行
心室細動
し、死亡が確認された。冠状動脈に有意狭窄はな
かったが、心筋炎が疑われた。部検の結果、微小梗
塞が認められた。
血栓症
血栓症による心室細動と考える。
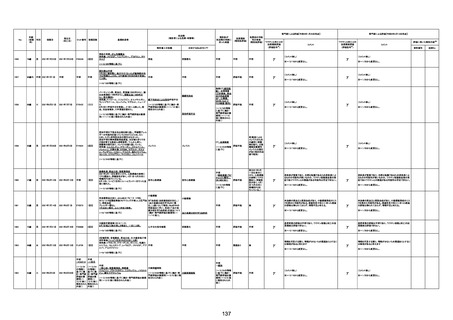
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
専門家による評価【令和5年3月10日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
資料番号
症例No
新たに血小板数減少(137, 000 /μL)が発症したこと、病
理学的診断において微小血栓症が確認されていることか
ら、ブライトン分類を「1」と評価します。
部検
関連あり
無
-
-
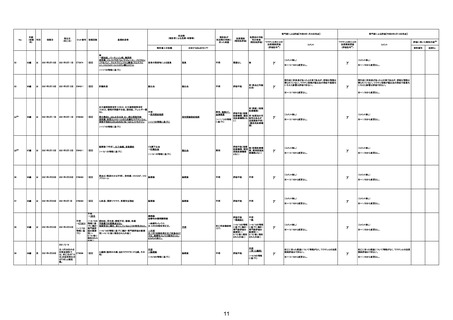
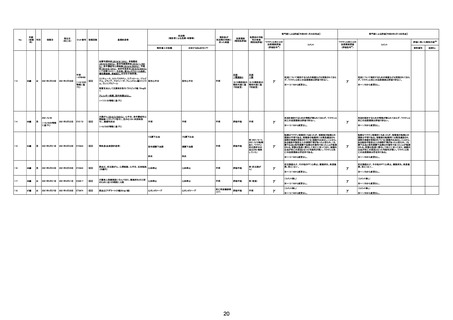
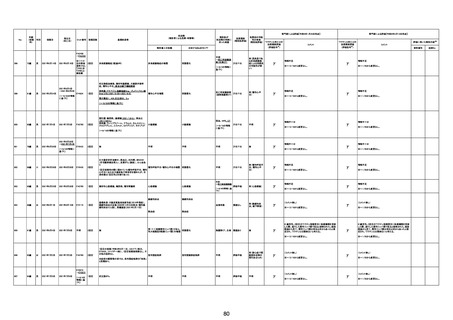
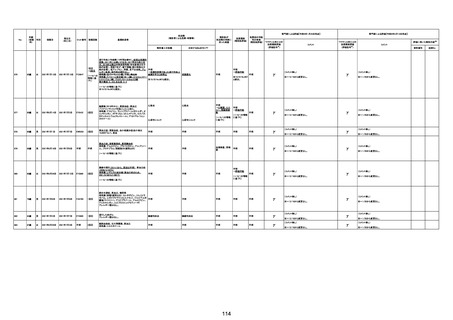
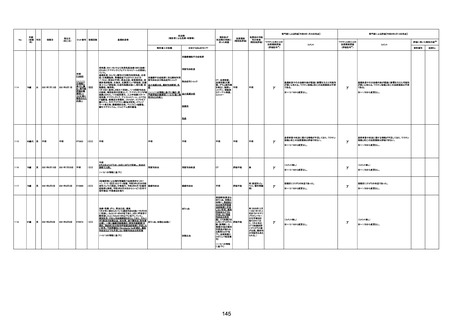
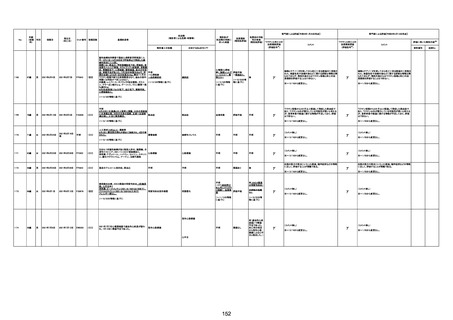
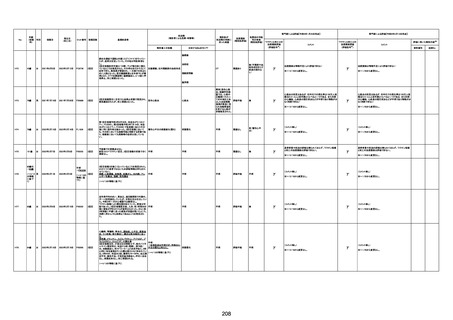
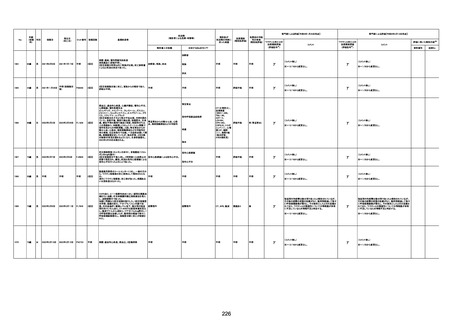
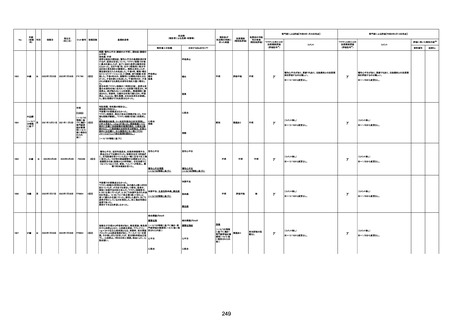
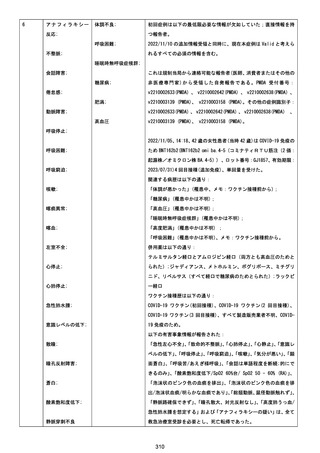
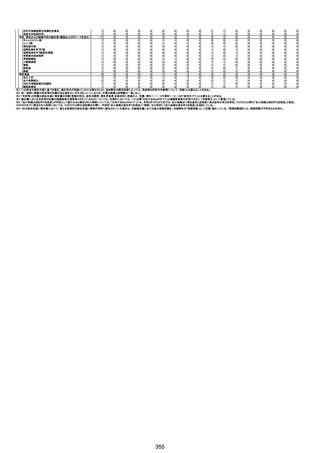
基礎疾患:乳癌、骨転移
アレルギー歴:ピリン系、造影剤にてアレルギー対応
併用薬:抗凝固剤内服中
2021/6/10ワクチン接種後より微熱、食欲低下あり、
有(乳癌、骨転
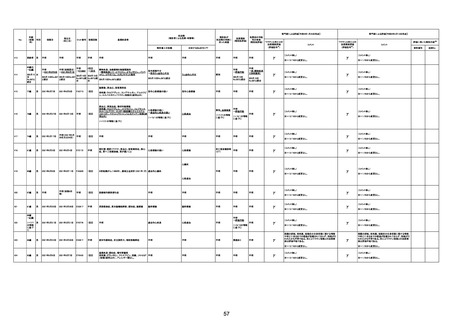
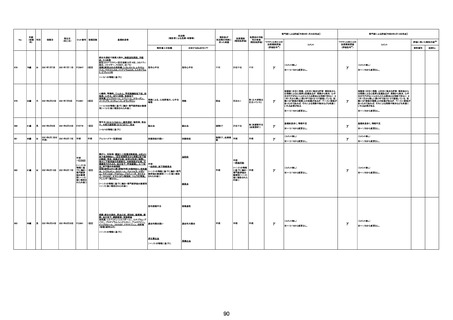
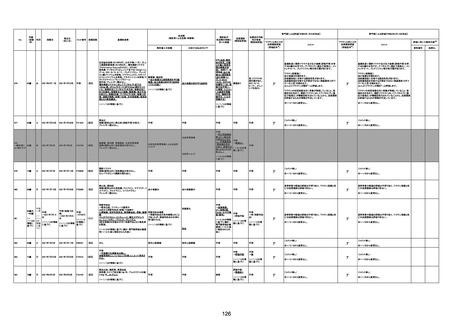
1791
79歳
女
2021年6月10日 2021年6月18日 FA2453
1回目
2021/6/18食事摂取できずるいそう著名。血液検査 不明
不明
不明
評価不能
移)
では肝機能悪化、心不全悪化が認められる。
コロンワクチン接種後より食欲低下著名となるも乳
癌・骨転移末期状態であり、死亡の原因は乳癌・骨
転移によるものと考える。
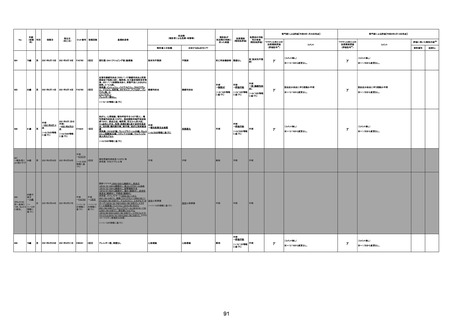
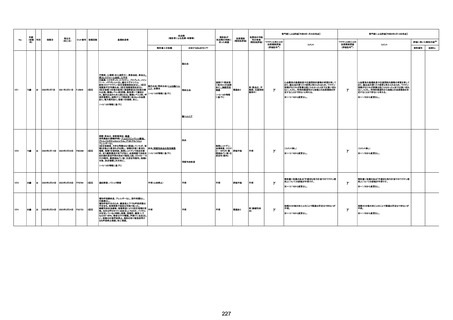
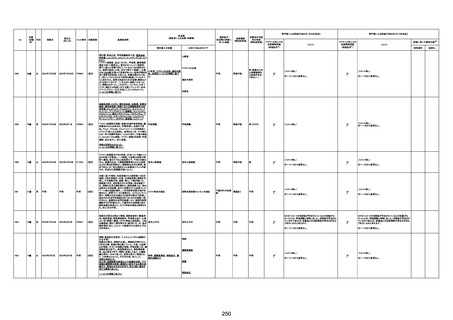
注1:各症例の記載は、令和3年2月17日~令和4年11月13日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年11月13日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:2021年3月30日に製造販売業者から厚生労働省に一報。詳細調査の後、4月6日に副反応疑い報告がなされた。
注4:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注5:接種医療機関及び解剖実施医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注6:接種医療機関及び検視医から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注7:接種医療機関及び主治医から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注8:搬送先医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:主治医及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注10:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1-1-2や資料1-2-2の「症状名(PT)」とは異なることがある。
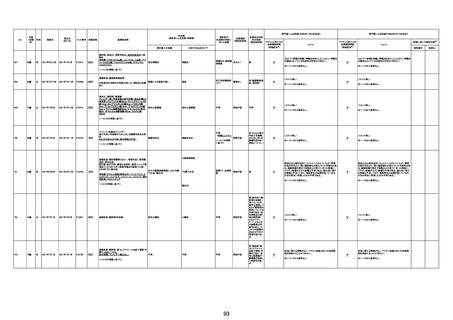
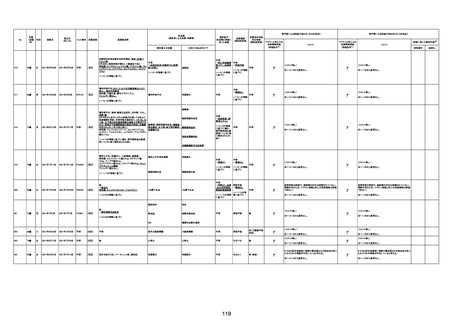
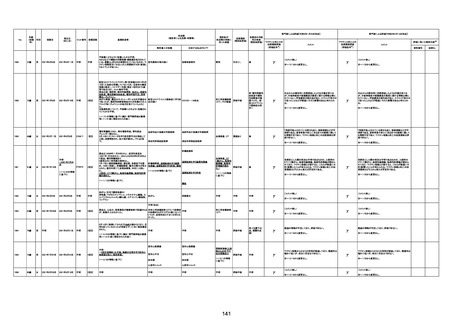
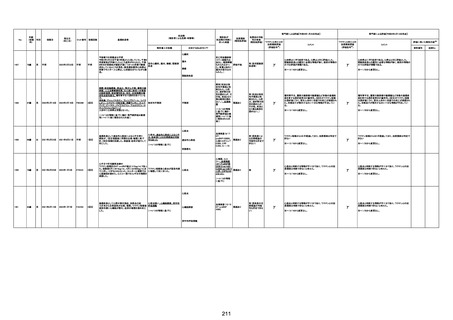
-
-
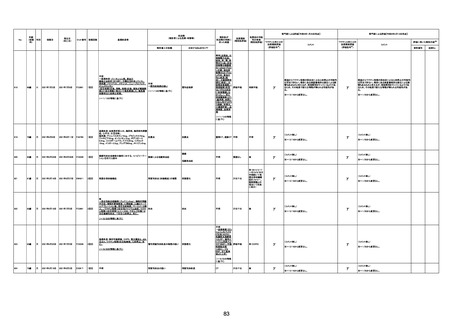
γ
γ
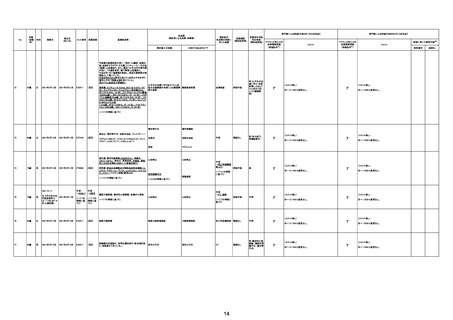
TTS/VITTとして報告されていますが、DICを除く鑑別診断
に必要な情報が不足しているために、報告された事象と
ワクチン接種との因果関係については、否定も肯定もでき
ません。
判断の経過情報不十分
資料1-2-2-1 21857
資料1-1-2-1 29849
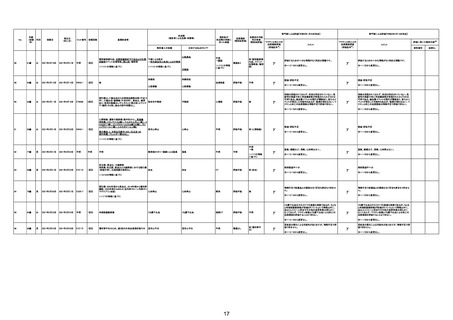
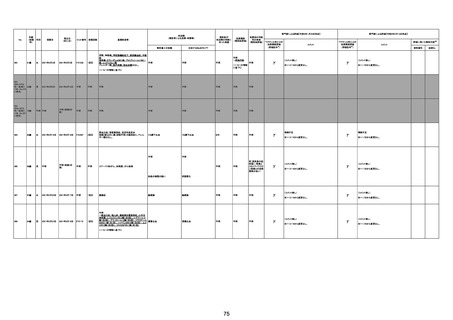
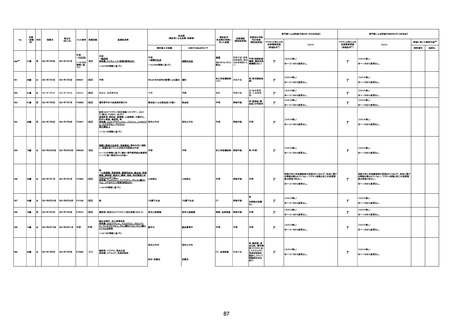
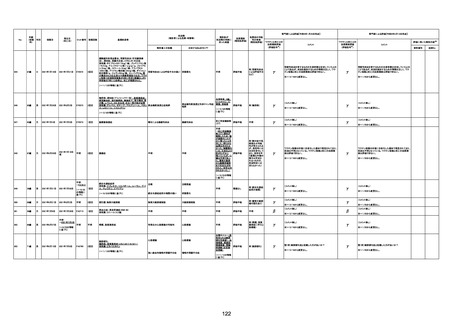
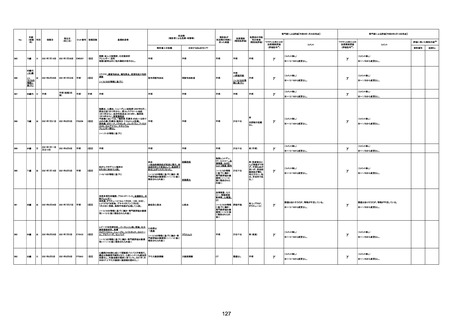
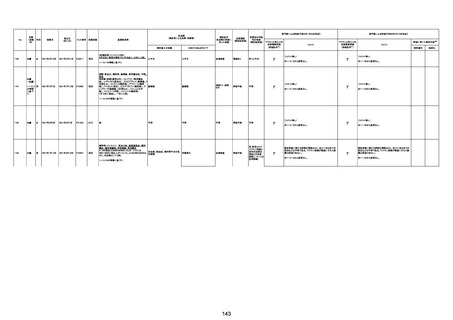
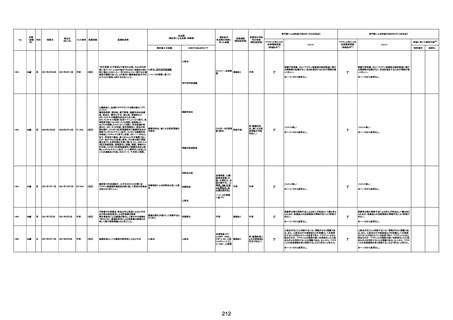
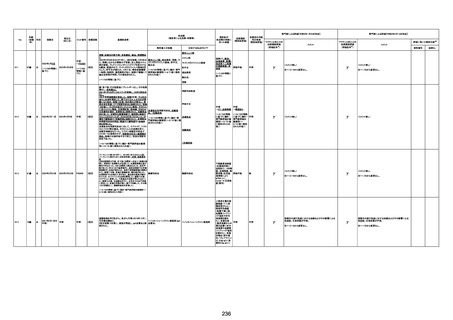
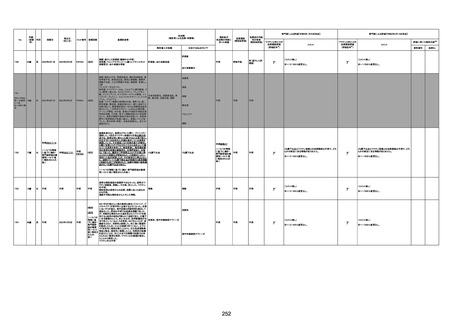
注11:入院時検査にて、抗CCP抗体高値陽性(142.0U/ml)、RF高値陽性(87IU/ml)、MMP3(111.5ng/ml)であり、関節リウマチに合致する所見を認めた。抗TNF製剤で抗核抗体や抗dsDNA抗体が陽転化する報告があるが、いずれも陰性で、他、抗RNP抗体陰性、抗Sm抗体陰性、抗リン脂質抗体(ループスアンチコアグラント、抗カルジオリピンIgG抗体、抗カルジオリピンβ2GP1抗体)は全て陰性であり、C3 70mg/dl、C4 18mg/dl、CH50 55.0U/mlとほ
ぼ正常範囲でSLE合併などによる血小板減少は考えにくい。IgG 1547mg/dl、IgA 693mg/dl、IgM 70mg/dlであった。ヘパリン使用歴はなく、HIT抗体は陰性であった。PA-IgGが206.0ng/10^7cells(基準値46ng/10^7cells以下)で、血小板表面に結合しているIgG(抗血小板抗体)を多数認めた。自己抗体の中で関節リウマチに関連したもの以外で入院以前に異常値を認めたものはないか、測定記録無しであった。本例ではPA-IgGが206.0ng/10^7cellsで、
血小板表面に結合しているIgG(抗血小板抗体)を多数認めた。長期間安定していた関節リウマチ患者に発生した突然の血小板減少の誘因として、以下考察する。抗血小板抗体は時に関節リウマチで陽転化する場合があるが、免疫グロブリンはいずれもポリクローナルな増加は見られず、関節リウマチの活動性も高くないことを踏まえれば、関節リウマチ自体により体内で抗血小板抗体が陽転化する可能性は低かったと考える。次に、本患者に使用
されていた注射剤(シンポニー(ゴリムマブ)及びミルセラ(エポエチンベータペゴル))においては、両薬剤ともに、頻度不明ながらも血小板減少が報告されている。両薬剤によって血小板減少を誘発した可能性は否定できないが、それが抗血小板抗体による機序であるかどうか不明であり、長期間安全に使用されてきた経緯を踏まえれば、両薬剤によって血小板減少が引き起こされた可能性は低いものと考える。引き続き症例の蓄積が必要であり、
早急な判断はできないが、本例はワクチンの2回目投与直後のタイミングであり、ワクチンによる因果関係は否定できないものと推察され、発症直前(4日前及び25日前)に投与されたワクチンが、致死的な血小板減少を誘発し、その結果、くも膜下出血をきたした原因薬剤として、現時点で最も可能性が高いと考える。
注12:当院受診歴(合計3回)
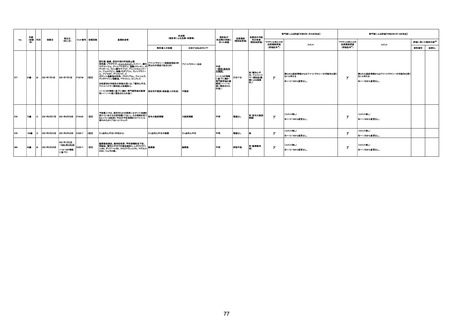
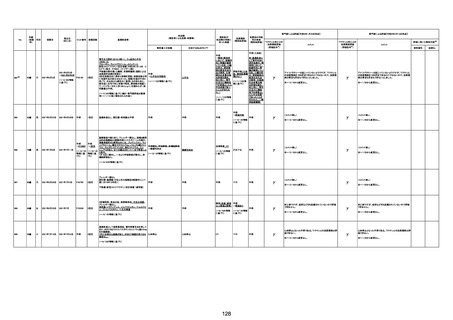
注13:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注14:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注15:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注16:2か所の搬送先医療機関から同一症例について報告あり。本表の記載内容は、両報告内容に基づく。
268