ガイドライン (208 ページ)
出典
| 公開元URL | https://www.caicm.go.jp/action/plan/index.html#influenza_initial_response_guideline |
| 出典情報 | 新型インフルエンザ等対策政府行動計画ガイドライン(8/30)《内閣感染症危機管理統括庁》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(第2章 準備期における対応)
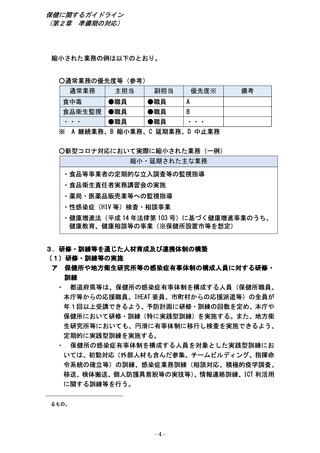
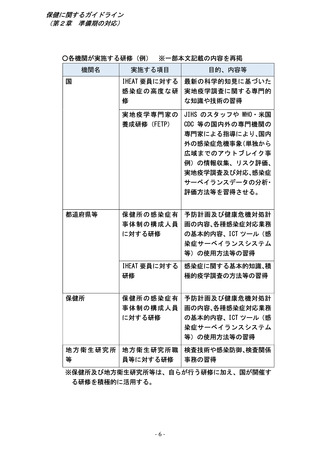
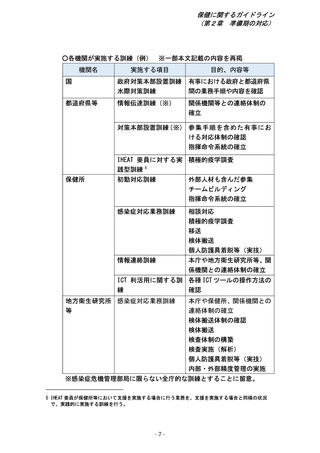
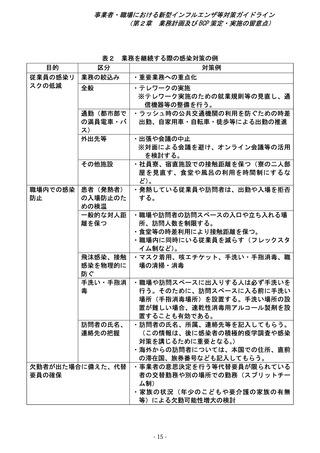
第2章 準備期における対応
1.ワクチンの研究開発(第3部第7章 1-1)
① 国は、
「ワクチン開発・生産体制強化戦略」に基づき、研究開発・生産
体制強化策に関係する省庁(府を含む。以下同じ。)で連携して取り組む。
ワクチンの国内開発・生産は国家の安全保障にも関わる問題であり、緊
急時の迅速な対応とともに、平時においても緊急時を念頭に置いた継続
的な研究開発が行われるよう関係部門の調整及び指示系統を明確にする。
なお、研究 開発にお いては国立研究開発法人日本医療研究開発機構
(AMED)内に設置された先進的研究開発戦略センター(SCARDA)と連携
して、平時から国産ワクチンの開発に資する研究開発を推進するととも
に、産学官連携による基礎研究から実用化までのシームレスかつ世界を
リードするワクチンの研究開発を推進する。また、国は、新型インフル
エンザ等の発生時に速やかにワクチンの開発に着手できるよう、想定し
たシナリオに基づく机上シミュレーション等を行い、必要な対応を確認
しておく。さらに、国は、基礎研究から上市後まで一貫して支援する。
(1-1-1)
② 厚生労働省は、新型インフルエンザ等に関するワクチンについては、
新型インフルエンザ等発生後、ワクチン製造用のウイルス株が決定され
てから6か月以内に全国民分のパンデミックワクチンを国内で製造する
体制を構築することを目指し、新しいワクチンの製造法や、新しい投与
方法等の研究・開発を促進するとともに、生産ラインの整備を推進する。
また、これらのワクチン開発に合わせて、小児や乳幼児への接種用量に
ついて検討を行う。(1-1-6)
③ 厚生労働省が確保した新型インフルエンザのプレパンデミックワクチ
ンについて、国立健康危機管理研究機構 1(Japan Institute for Health
Security)(以下「JIHS」という。)は、有効性等に関する非臨床試験を
行った後に、臨床試験を実施し、安全性と免疫原性 2の検証を行い、新型
インフルエンザ発生時にプレパンデミックワクチンで誘導される免疫の
交差性の確認ができるよう、血清の保存等の対応を行う。
④ 厚生労働省は、発生した新型インフルエンザ等の種類や型、変異状況
等に応じて、製造株を変更できるよう、SCARDA で支援しているワクチン
1 JIHS 設立までの間、本文書における「JIHS」に関する記載は、JISH 設立前に相当する業務を行う「国
立感染症研究所」若しくは「国立国際医療研究センター」又は「国立感染症研究所及び国立国際医療研
究センター」に読み替えるものとする。
2 病原体の抗原が抗体の産生や細胞性免疫を誘導する性質。
-4-