ガイドライン (316 ページ)
出典
| 公開元URL | https://www.caicm.go.jp/action/plan/index.html#influenza_initial_response_guideline |
| 出典情報 | 新型インフルエンザ等対策政府行動計画ガイドライン(8/30)《内閣感染症危機管理統括庁》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(第2章 準備期の対応)
第2章 準備期の対応
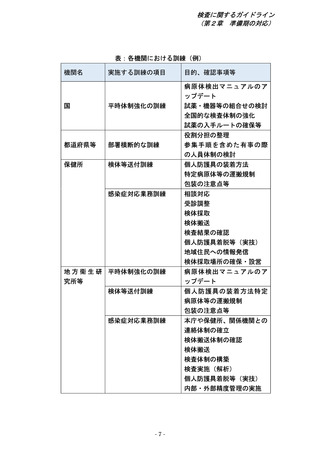
1.感染症危機対応時における検査の考え方
ⅰ)厚生労働省は、国立健康危機管理研究機構 3(Japan Institute for Health
Security)
(以下「JIHS」という。)と連携し、新型インフルエンザ等の発生
後のフェーズ(初動期、対応期)、検査の目的、活用できる検査の種類、検
査を実施する機関、各検査実施機関における検査実施可能数等の要素を組み
合わせ、検査体制構築のための戦略を策定する。
ⅱ)厚生労働省は、実施機関により実施可能な検査が異なることに留意し、JIHS
や都道府県等、民間検査機関等と早期から連携し、有事において迅速に以下
の種類の検査体制を立ち上げられるよう準備する。
核酸増幅検査
核酸増幅検査のうち、PCR 検査は、病原体遺伝子(核酸)を特異的に増
幅させ、採取された検体中の病原体遺伝子の存在を確認する手法である。
有事においては、JIHS が、入手した病原体ゲノム情報を基に PCR プライマ
ー等(プローブ、陽性コントロール等を含む。以下同じ。)を作成し、病原
体ゲノム情報入手後約2週間で関係機関に配布し、検疫所・地方衛生研究
所等の関係機関における迅速な検査体制立上げを目指す。その後、医療機
関等(研究機関を含む。)や民間検査機関(協定締結機関を含む。)におい
ても検査体制を構築する。
抗原定性検査(迅速検査キット)
抗原定性検査は、イムノクロマトグラフィ法 4等により病原体の抗原を
検知する手法である。有事においては、既存の迅速検査キットの有効性を
確認するとともに、新たに迅速検査キットを開発する場合は、新型インフ
ルエンザ等の発生後約1~2か月程度で JIHS にて実施可能となることが
想定され、その後、検疫所、医療機関等(研究機関を含む。)
・民間検査機
関(協定締結機関を含む。)にて実施可能となる。
抗原定量検査
抗原定量検査は、当該感染症専用の測定機器を用いて化学発光酵素免疫
測定法等により病原体の抗原量を測定する手法である。有事においては、
当該感染症専用の測定機器の開発に時間を要するため、新型インフルエン
ザ等の発生後約5か月を過ぎた頃から JIHS にて実施可能となることが想
定され、その後、検疫所・地方衛生研究所等、医療機関等(研究機関を含
3 JIHS 設立までの間、本文書における「JIHS」に関する記載は、JIHS 設立前に相当する業務を行う「国
立感染症研究所」若しくは「国立国際医療研究センター」又は「国立感染症研究所及び国立国際医療研
究センター」に読み替えるものとする。
4 新型コロナやインフルエンザ等の迅速検査キットに採用される抗原定性検査法。病原体の抗原を認識し
てキットの陽性のラインが呈色する。
-2-