IMDRF 不具合用語集を踏まえた医療機器不具合用語集の公表について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00016.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和5年度第2回 3/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
事
務
連
絡
令和 6年1月 12 日
(別
記)
御中
独立行政法人医薬品医療機器総合機構
医療機器品質管理・安全対策部
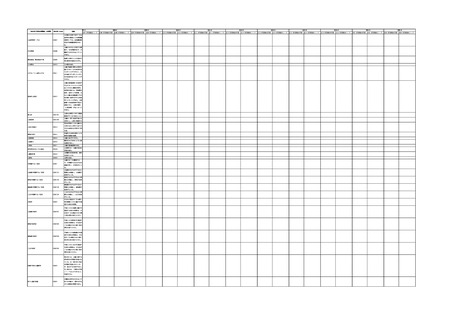
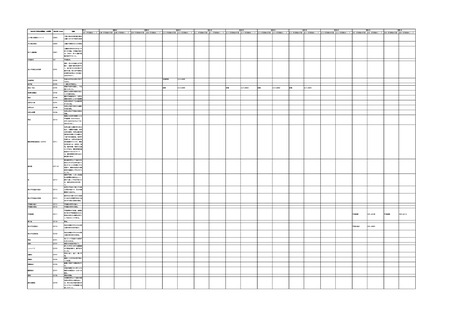
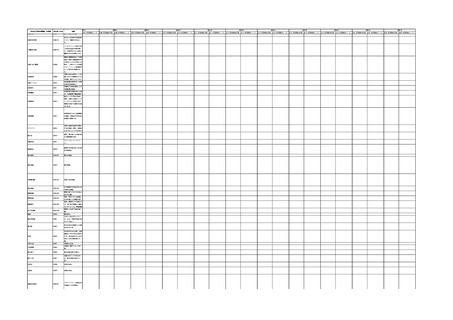
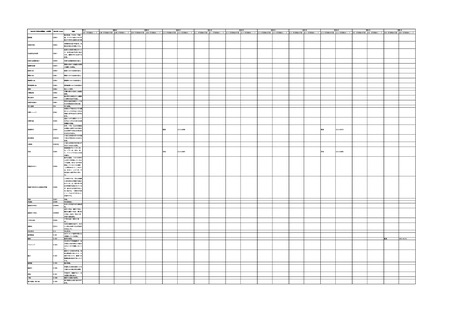
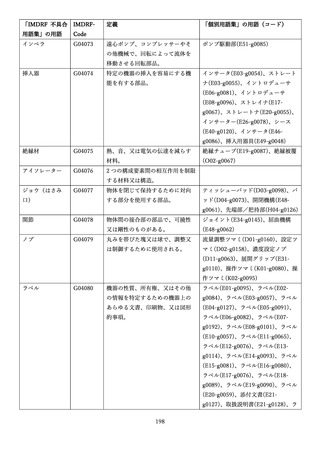
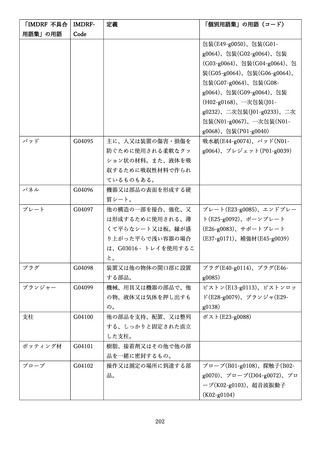
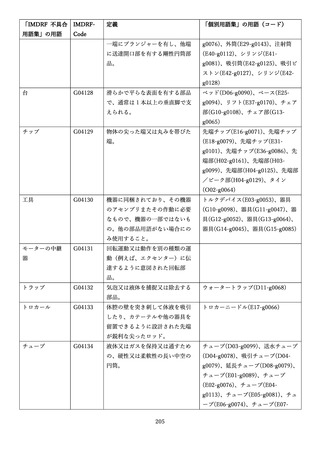
IMDRF 不具合用語集を踏まえた医療機器不具合用語集の改訂について
(その2)
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和
35 年法律第 145 号)第 68 条の 10 第1項の規定に基づく医療機器の不具合等
の報告(以下「不具合等報告」という。)については、「医療機器の不具合等報
告について」(令和2年1月 31 日付け薬生安発 0131 第1号厚生労働省医薬・
生活衛生局医薬安全対策課長通知)によりその取扱いが示され、同通知の別添
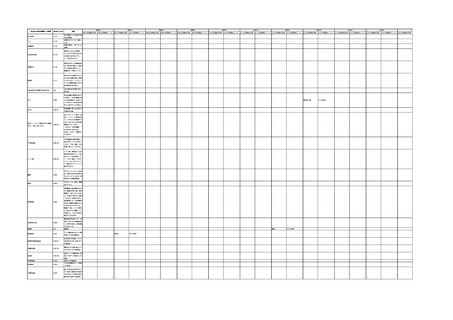
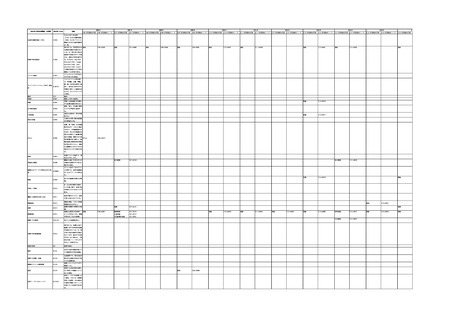
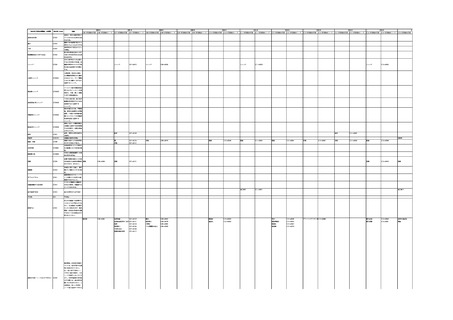
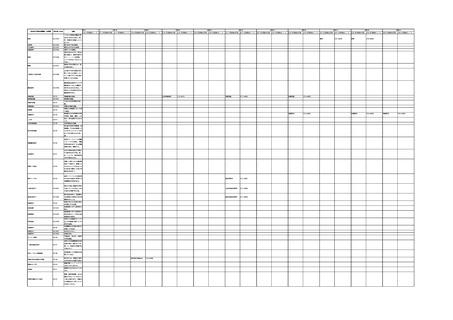
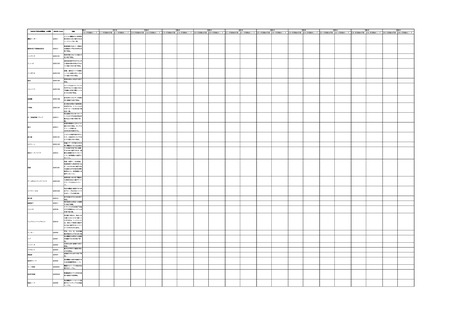
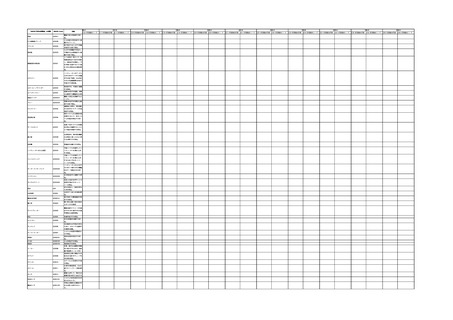
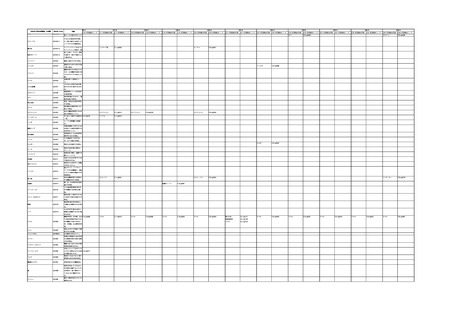
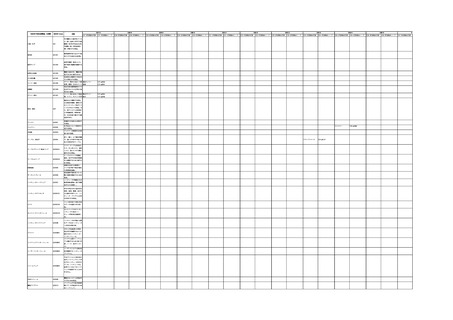
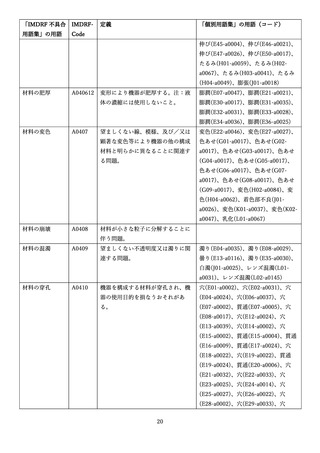
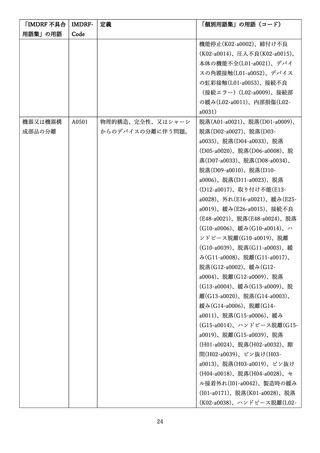
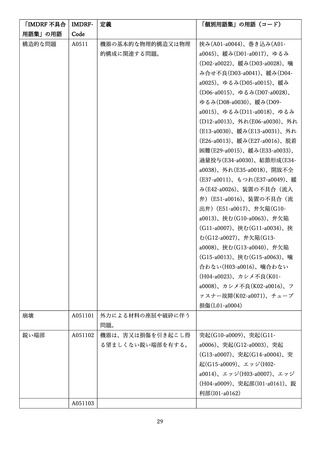
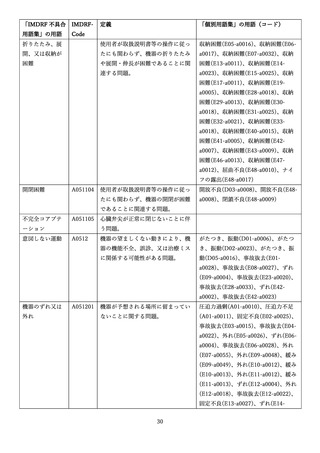
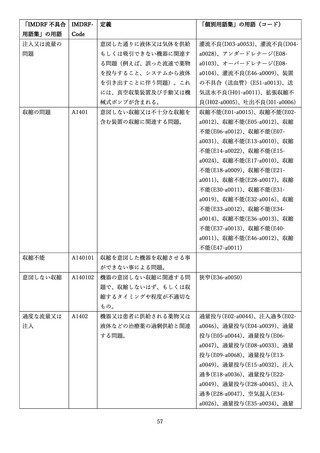
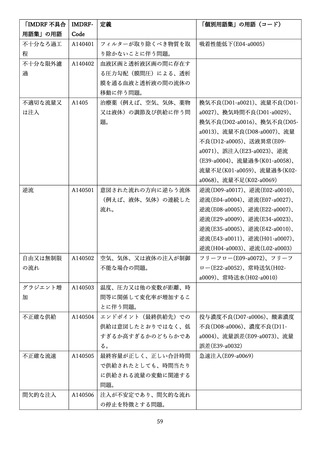
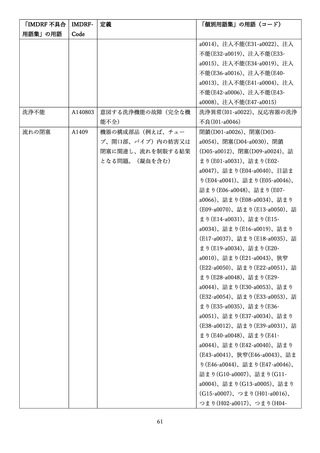
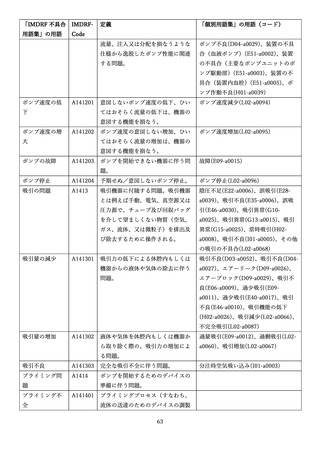
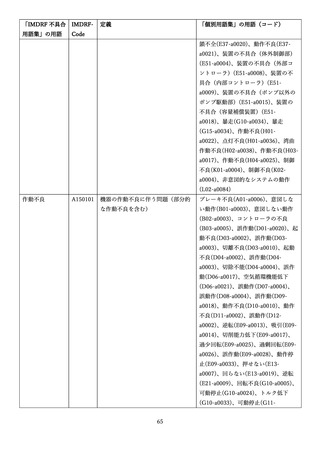
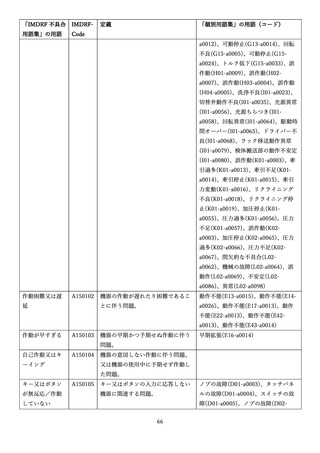
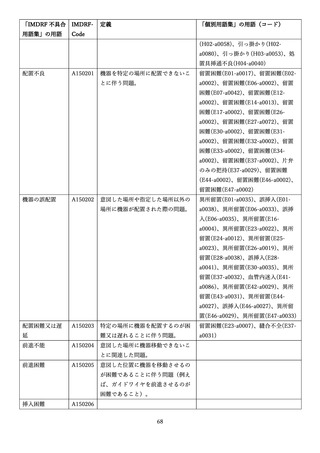
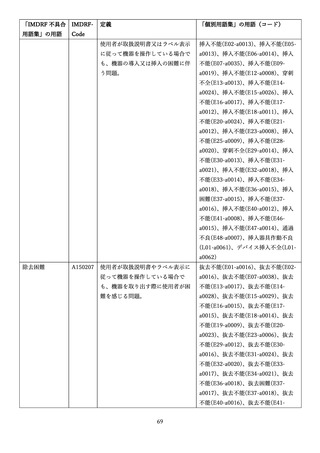
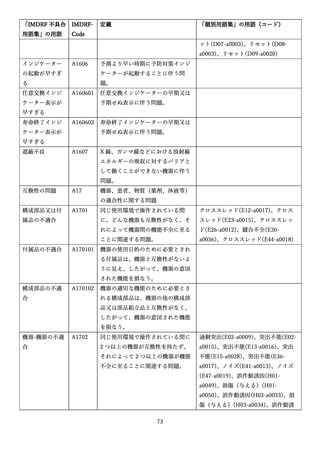
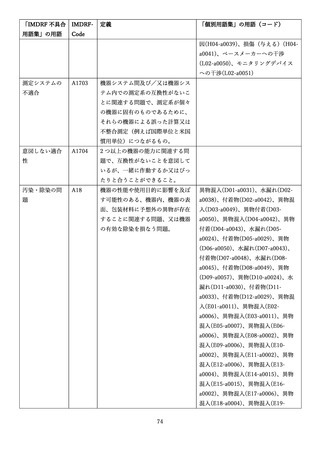
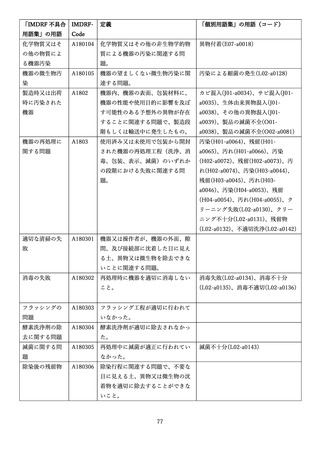
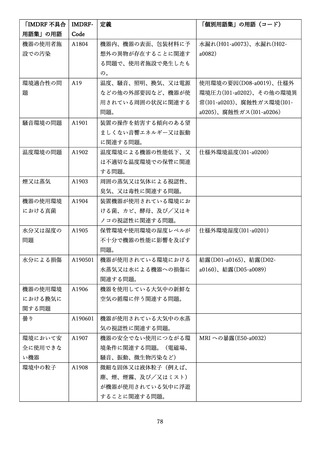
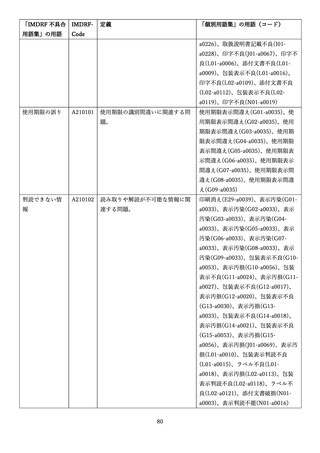
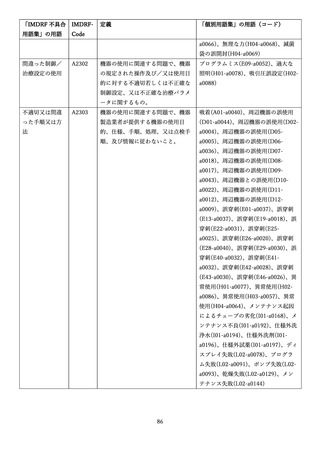
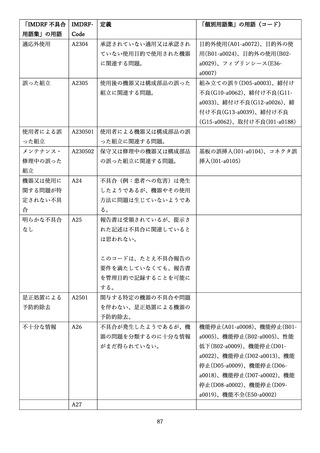
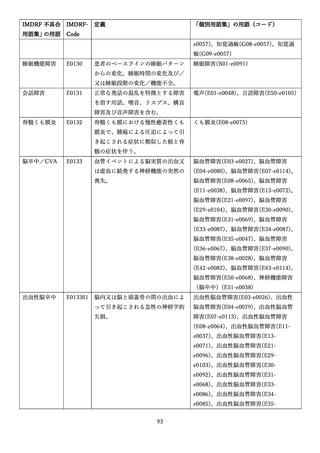
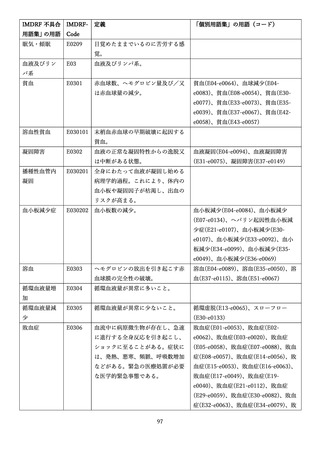
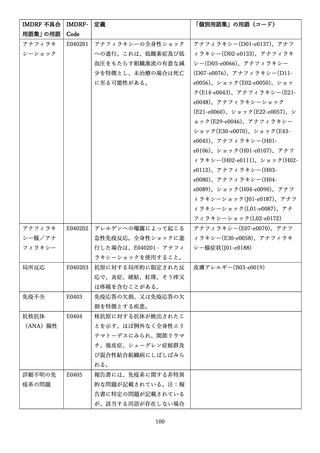
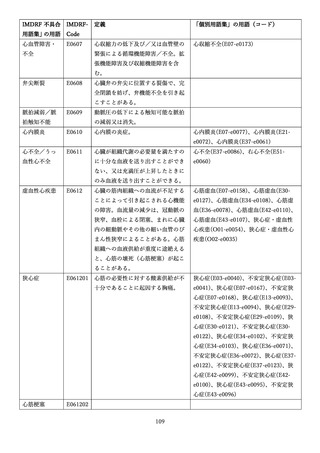
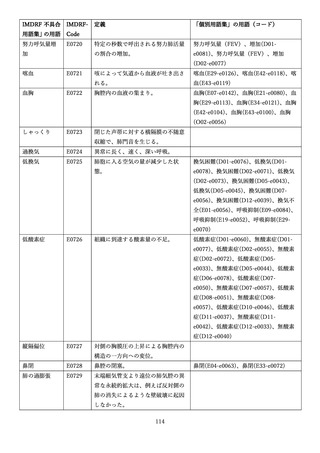
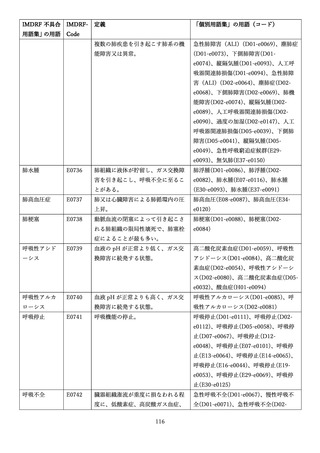
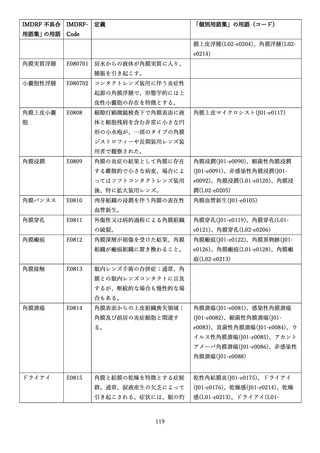
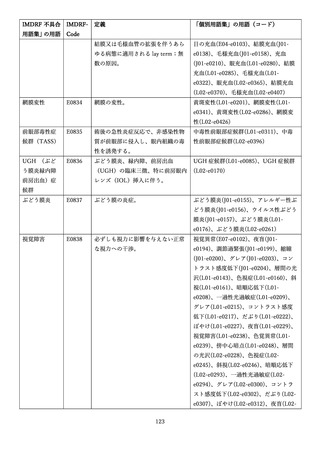
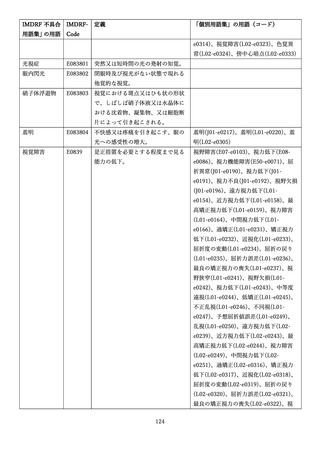
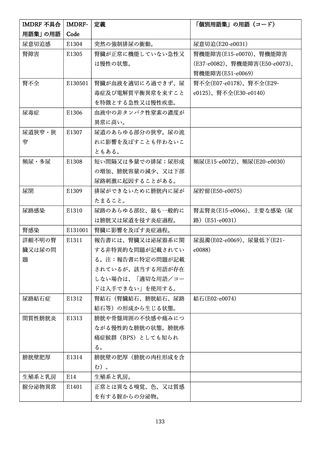
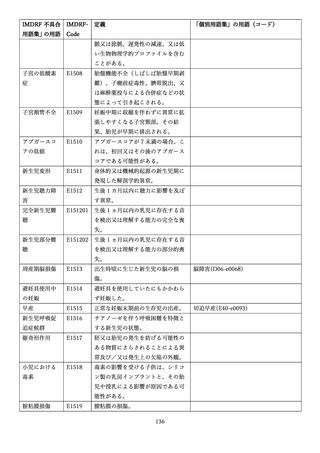
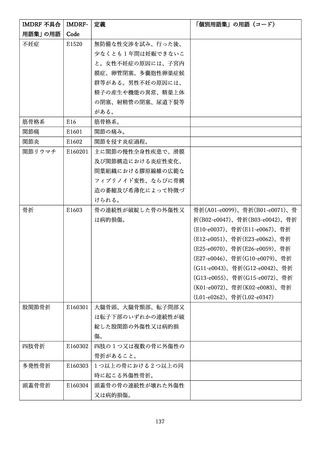
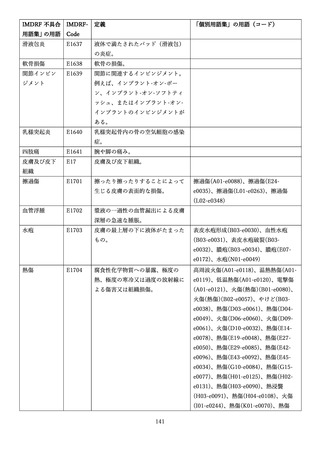
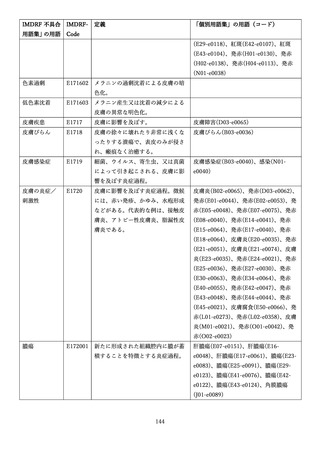
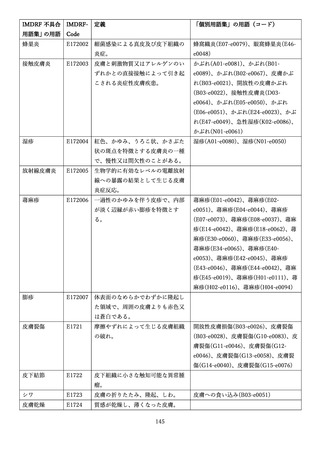
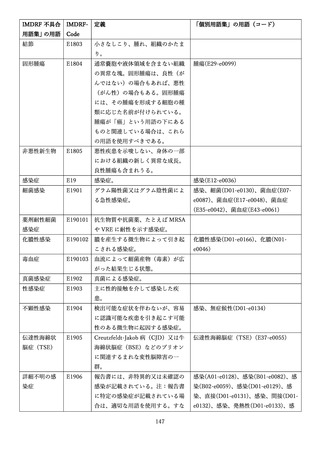
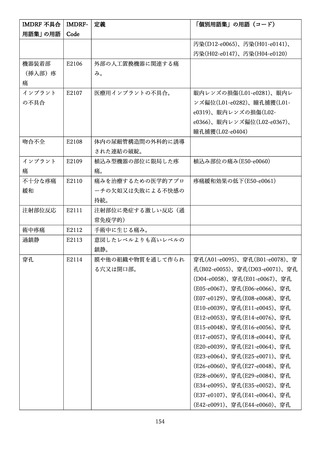
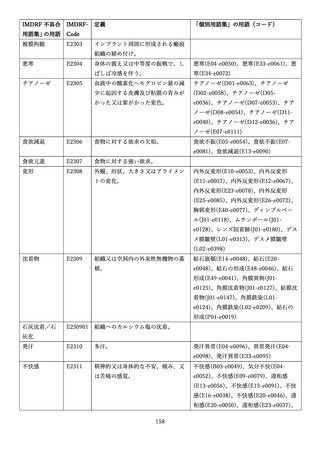
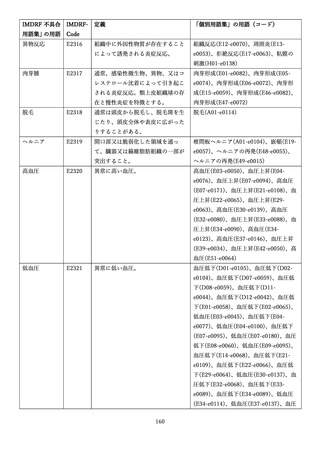
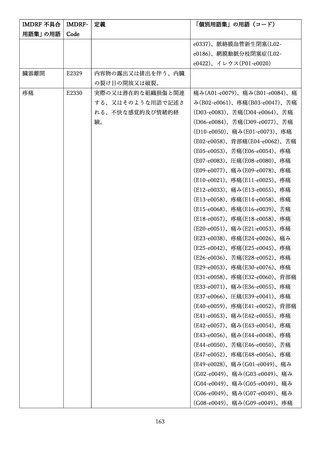
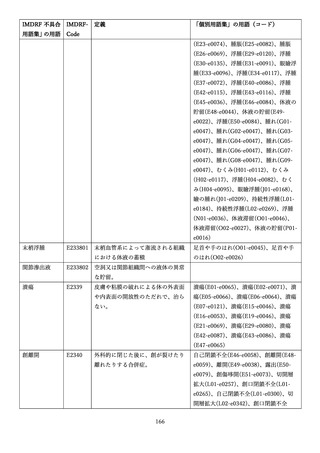
4.(1)ケにおいて、不具合等報告の項目「患者等の健康被害名(Pa.7.2r.1)」、
「医療機器の不具合名(Pa.8.2r.1)」、「調査方法(Ca.3.1r.1)」、「調査結果
(Ca.3.2r.1)」、
「結論(Ca.3.3r.1)」及び「不具合が発生した部品(Ca.3.5r.1)」
の用語選択には、原則、
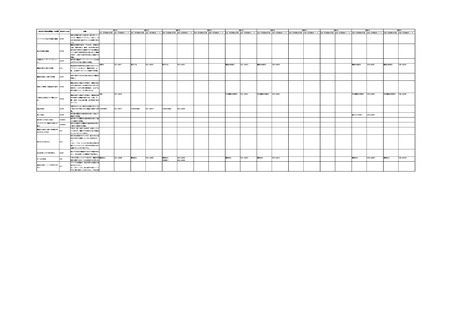
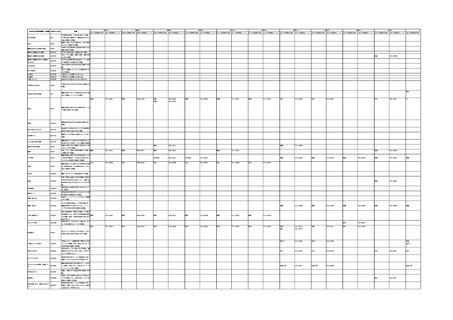
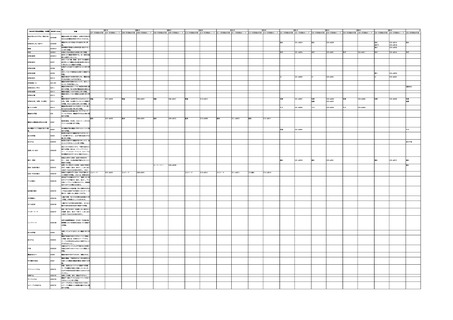
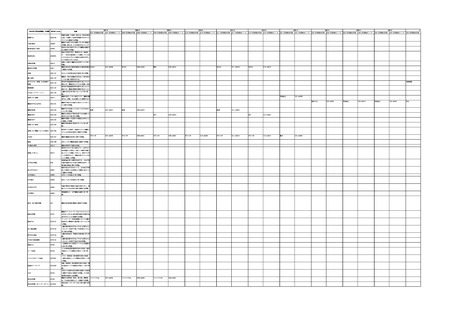
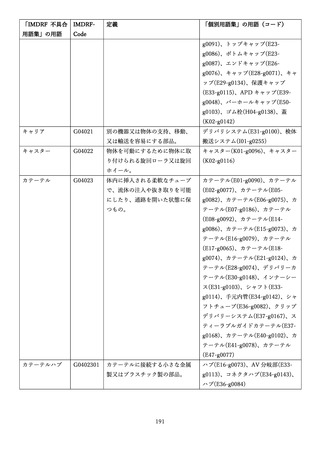
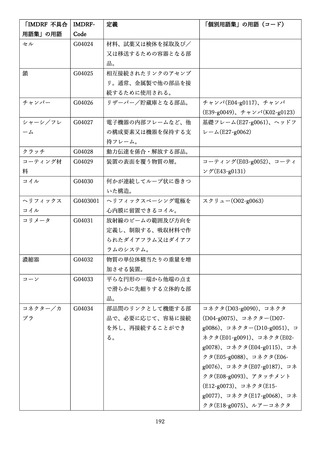
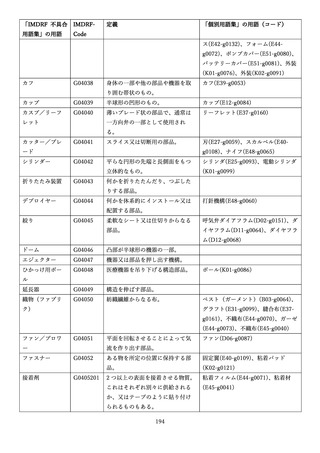
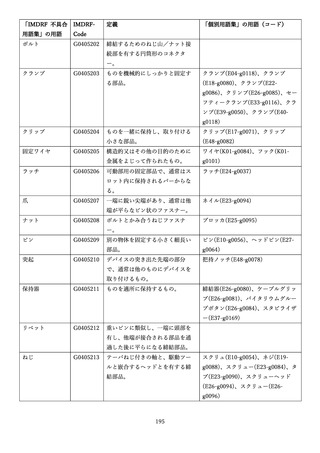
「医療機器不具合用語集」を活用することとされていま
す。
また、医療機器不具合用語集については、
「IMDRF 不具合用語集を踏まえた医
療機器不具合用語集の公表について」(令和3年 11 月 12 日付け独立行政法人
医薬品医療機器総合機構医療機器品質管理・安全対策部事務連絡)において、
国際医療機器規制当局フォーラム(IMDRF)にて取りまとめられた「IMDRF
terminologies for categorized Adverse Event Reporting (AER): terms,
terminology structure and codes」の翻訳版(以下「IMDRF 不具合用語集」と
いう。)を踏まえた医療機器不具合用語集が取りまとめられた旨をお知らせして
おります。
今般、
「医療機器の IMDRF 用語集の翻訳版の改訂について(その3)」
(令和5
年 12 月 11 日付け厚生労働省医薬局医薬安全対策課事務連絡)において、IMDRF
不具合用語集の改訂版が周知されたことを踏まえ、一般社団法人 日本医療機器