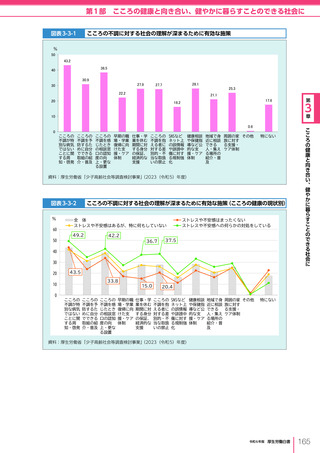
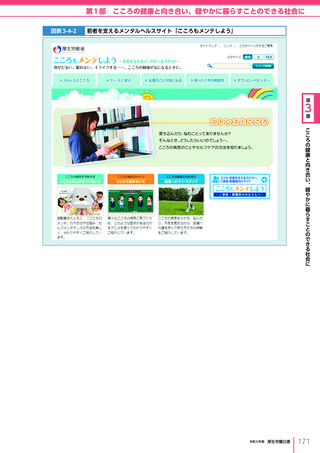
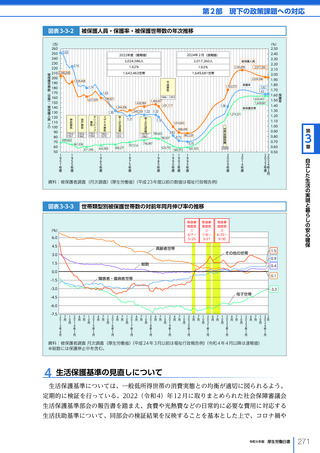
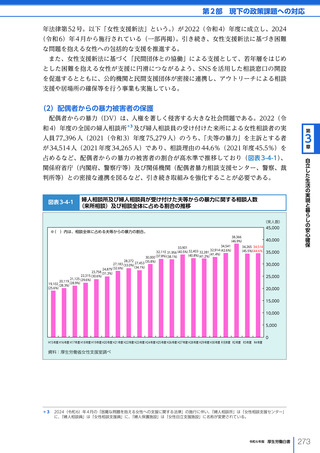
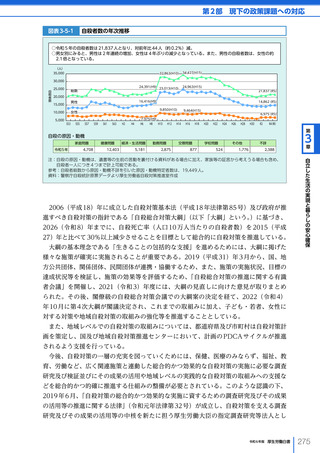
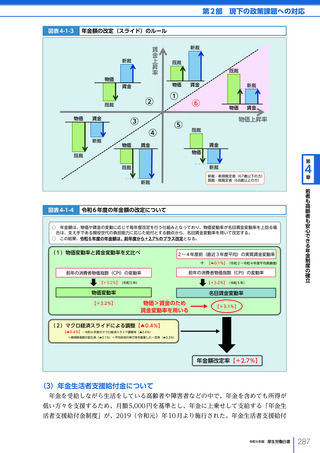
令和6年版厚生労働白書 全体版 (324 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/wp/hakusyo/kousei/23/index.html |
| 出典情報 | 令和6年版厚生労働白書(8/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)創薬力の強化
医療用医薬品の売上額世界上位の品目のうち日本起源のものが減少し、日本起源の品目
の世界市場におけるシェア(売上高)についても低下するなど、我が国の創薬力に関する
課題が指摘されている。創薬力の強化に向けては、起業家、アカデミア、行政、投資家な
どが相互に協力しながら、スタートアップの立ち上げと成長を支える「エコシステム」を
構築することが重要である。政府としては、2023(令和 5)年 12 月に「創薬力の向上に
より国民に最新の医薬品を迅速に届けるための構想会議」を立ち上げ、我が国の医薬品産
業の国際競争力の低下といった課題への対応を含めて議論を行っている。その議論を踏ま
えつつ、厚生労働省においても、人材・資金について国際的な連携を通じて日本に呼びこ
むこと等により、研究から開発への橋渡しなどで創薬エコシステムの活性化を図るための
施策を検討している。
(3)臨床研究・治験環境の整備
革新的な医薬品・医療機器の創出のためには、臨床研究・治験の推進が不可欠である。
第
章
5
厚生労働省では、日本発の革新的医薬品・医療機器の開発などに必要となる質の高い臨床
研究を推進するため、国際水準の臨床研究や医師主導治験の中心的役割を担う病院を
2015(平成 27)年 4 月から、臨床研究中核病院(2024(令和 6)年 4 月 1 日現在、15 病
医療関連イノベーションの推進
院)として医療法上に位置づけている。臨床研究中核病院は、質の高い臨床研究・治験を
自ら実施するだけでなく、他施設における臨床研究・治験の計画立案や実施について支援
する Academic Research Organization(ARO)機能を有することから、ARO 機能を
活用し多くのエビデンスを構築することで、我が国における様々な革新的医療技術の創出
を推進している。
厚生労働省としては、2019(令和元)年に取りまとめられた「臨床研究・治験の推進
に関する今後の方向性について」を踏まえ、更なる臨床研究・治験の推進のため、小児疾
病・難病等の研究開発が進みにくい領域の取組み等を進めている。
また、引き続き、臨床研究中核病院を中心に、研究者が国際共同臨床研究・治験を円滑
に実施するための体制構築や、臨床研究従事者等の養成を行うなど、国内における臨床研
究環境の更なる向上を目指していく。なお、これらの事業については、国民の健康寿命の
延伸の観点から、医療分野の研究開発を政府として総合的に推進するため、2015 年 4 月
に設立された国立研究開発法人日本医療研究開発機構(AMED)において、文部科学省
で整備している橋渡し研究支援機関と一体的に整備を進め、革新的な医薬品・医療機器の
創出を加速することとしている。
さらに、疾患登録システムを活用して治験対象となる患者を把握すること等で、効率的
な治験が実施できる環境を整備することにより、企業等による国内臨床開発を加速し、新
薬等の早期開発により国民の健康寿命を延伸するため、国立高度専門医療研究センター
(ナショナルセンター)や学会等が構築する疾患登録システムなどの利活用を促進する
「クリニカル・イノベーション・ネットワーク」の取組みを推進している。
308
令和 6 年版
厚生労働白書