令和6年版厚生労働白書 全体版 (405 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/wp/hakusyo/kousei/23/index.html |
| 出典情報 | 令和6年版厚生労働白書(8/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
現下の政策課題への対応
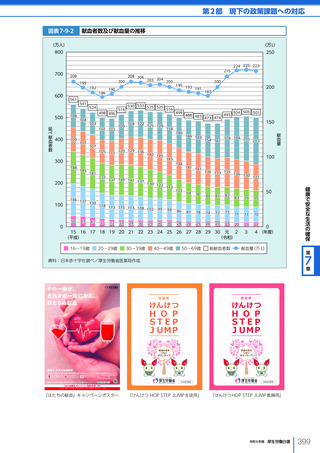
名、2023 年度における非血縁者間の造血幹細胞移植の実施件数は、2,459 件(骨髄移植
773 件、末梢血幹細胞移植 319 件、臍帯血移植 1,367 件)となった。
(4)臍帯血を利用した医療の適切な提供について
契約者の意に沿わない臍帯血の提供を防ぎ、臍帯血を利用した医療が適切に行われるよ
う、2017(平成 29)年に臍帯血プライベートバンク*24 に対し、業務内容等の国への届
出を求めるとともに、厚生労働省ホームページにおいて公表する等の取組みを行ってい
る。また、2019(平成 31)年に「移植に用いる造血幹細胞の適切な提供の推進に関する
法律の一部を改正する法律」により、公的さい帯血バンク以外の事業者による非血縁者間
の造血幹細胞移植に用いる臍帯血の提供等を禁止している。
第7節
医薬品・医療機器の安全対策の推進等
医薬品等は、基本的にヒトの身体に何らかの影響を及ぼして疾患の治療などを行うもの
であるため、それが期待どおりに治療効果として現れる一方で、予期しない副作用が起き
ることもある。医薬品等の使用においては、これらのベネフィットとリスクのバランスが
重要であることから、治験等のデータに基づき有効性と安全性の両面についての検討を行
い、厚生労働大臣の承認を得てから販売される。しかし、治験等を通じて医薬品等の承認
までに得られる安全性に関する情報には限界があるため、市販後に副作用情報などを収集
第
し、その情報を適切に分析・評価した上で、必要な安全対策上の措置を迅速に講じていく
健康で安全な生活の確保
1 医薬品等の安全対策
7
ことが必要である。
章
(1)副作用情報等の報告制度
市販後の副作用情報等は、
「医薬品、医療機器等の品質、有効性及び安全性の確保等に
関する法律」
(以下「医薬品医療機器等法」という。
)に基づいて医薬品等の製造販売業者
又は医薬関係者から厚生労働大臣に報告することとされており、副作用等の国内症例報告
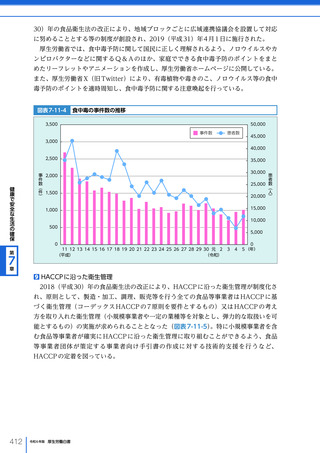
件数は、製造販売業者及び医薬関係者ごとに、2022(令和 4)年度においては、医薬品
は年間 71,231 件及び 11,819 件、医療機器は 27,364 件及び 292 件、再生医療等製品は
491 件及び 2 件であった。
また、2019(平成 31)年 3 月 26 日より、患者又はその家族からの、医薬品による副
作用が疑われる症例についての報告受付を正式に開始した。
(2)副作用情報等の評価及び提供
厚生労働省は、PMDA と連携し、企業や医薬関係者から報告された副作用情報等につ
いて、迅速・的確に評価するとともに、その結果に基づいて、必要に応じて電子化された
* 24 臍帯血プライベートバンク(民間臍帯血バンク):公的さい帯血バンクとは異なり、臍帯血を採取された母親本人やその家族の治療
のために、現在はまだ医療技術としては確立されていない再生医療などに将来利用する場合に備えて、母親との間で委託契約を結び、保
管費用の支払いを受けて、臍帯血を保管する事業者。
令和 6 年版
厚生労働白書
389