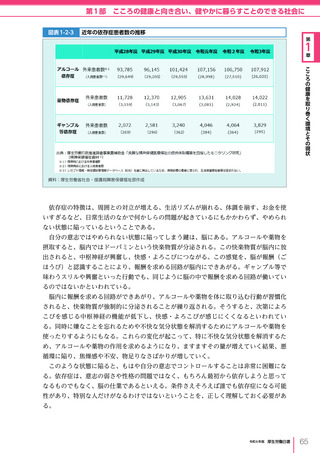
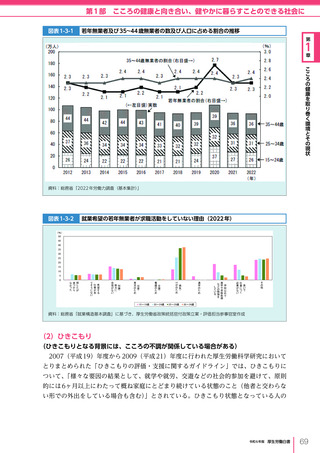
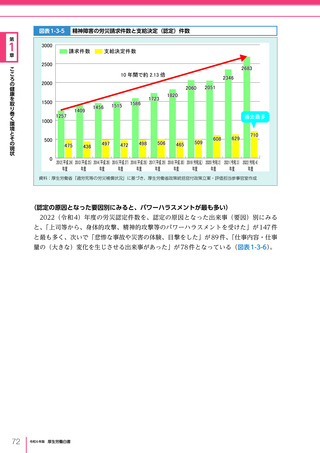
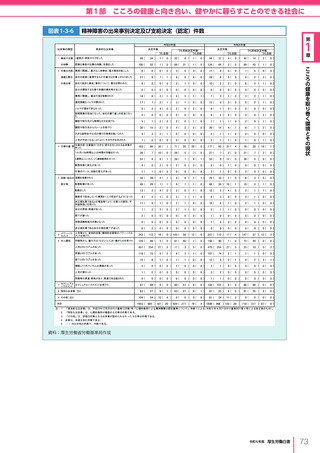
令和6年版厚生労働白書 全体版 (416 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/wp/hakusyo/kousei/23/index.html |
| 出典情報 | 令和6年版厚生労働白書(8/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
血液製剤は、原料である人血液に由来する感染症等の発生を完全には排除できないもの
であるため、技術の進歩や社会情勢の変化に即応した安全性確保の推進及び患者に真に必
要な場合に限った適正使用を求めている。
輸血用血液製剤は、赤血球製剤、血漿製剤、血小板製剤、全血製剤に大別される。特に
血小板製剤においては、その有効性を維持するため、常温で保存する必要があるなどの特
性から細菌感染のリスクがある。そのため、献血時の問診、消毒、初流血除去、保存前白
血球除去、有効期限の制限などの種々の安全対策がとられている。それでもなお、輸血用
血液製剤からの細菌感染事例の報告はされており、
「人血小板濃厚液の使用時の安全性確
保措置の周知徹底について」を発出し、輸血用血液製剤の使用時の安全対策の徹底につい
て改めて周知している。加えて、更なる安全対策として、細菌スクリーニングの導入に向
けて検討を進めている。
国内の輸血用血液製剤には、B 型肝炎ウイルス(HBV)
、C 型肝炎ウイルス(HCV)、
ヒト免疫不全ウイルス(HIV)などに対する抗原抗体検査、個別検体での核酸増幅検査
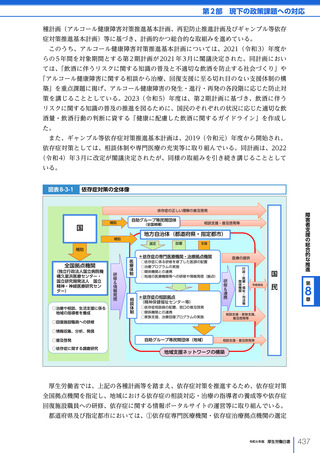
健康で安全な生活の確保
第
章
7
(Nucleic Acid Amplification Testing:NAT)や供血者からの遡及調査の徹底等の対
応を講じてきた。2020(令和 2)年 8 月からは E 型肝炎ウイルス(HEV)に対する NAT
も全国的に導入されるなど、今日、我が国における血液製剤は世界でも有数の安全性を有
するものといえる。
なお、血漿分画製剤のウイルスに対する安全性については、献血者の問診・検査、製造
工程でのウイルス除去・不活化処理及びそのウイルスクリアランス能の評価並びに採血後
情報及び輸血後情報等の遡及調査を適切に実施することが重要であり、2024(令和 6)
年 3 月には、
「血漿分画製剤のウイルスに対する安全性確保に関するガイドライン」の一
部を改正し、ウイルスクリアランス試験についての原則的な考え方等を示している。
新型コロナウイルスワクチン接種後の献血者の採血制限期間については、mRNA ワク
チンについて接種後 48 時間、ウイルスベクターワクチンについて接種後 6 週間、組換え
タンパク質ワクチンについて接種後 24 時間としているほか、新型コロナウイルス既感染
者の採血制限期間については、2023(令和 5)年 12 月より症状消失(無症候の場合は陽
性となった献体の検体採取日)から 2 週間に変更されている。
輸血用血液製剤に関する副作用報告件数の推移については、非溶血性副作用はアレル
ギー反応の頻度が最も高いが、発症年齢分布が高齢者に多い輸血に伴う心不全である輸血
関連循環負荷(Transfusion associated circulatory overload:TACO)も含まれる。
各都道府県には、医療機関、血液製剤を供給している赤十字血液センター、そして管轄
する行政の三者による合同輸血療法委員会が設置されており、適正かつ安全な輸血療法を
目指している。
400
令和 6 年版
厚生労働白書