資料1-2-3-2 薬機法に基づく製造販売業者からの副反応疑い報告状況について(スパイクバックス筋注・集計対象期間における基礎疾患等及び症例経過) (254 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
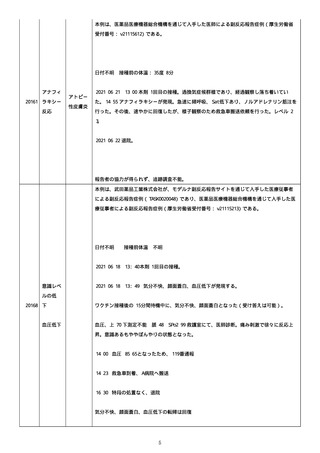
本例は、当社 MR を介して医師により報告された。
徐脈は企業により重篤と判断された。
2021/09/04
12:09 本剤 1 回目の接種。12:18 接種後何も聞こえない状態になり、めま
いと気分不良を認めた。迷走神経反射が疑われる。立ちくらみにより倒れそうになり、救護
21528
徐脈
室で 20 分臥床し、症状改善。ファーストバイタルで徐脈、低血圧あり。血圧 88/41、脈拍
47、SPO2 98%。5 分ほど座位になり、気分不良見られなかった。12:45 観察終了。血圧
90/52、脈拍 60、SPO2 98%。
何も聞こえない状態、迷走神経反射疑い、徐脈の転帰は、回復。
報告者の協力が得られず、追跡調査不能。
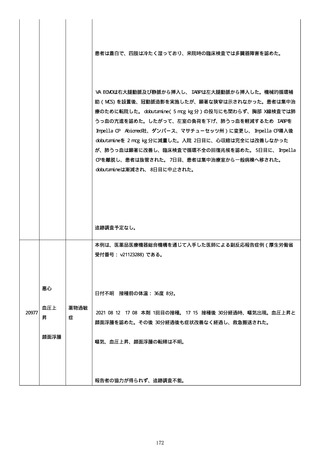
本例は、MR を介した消費者からの報告である。
皮下出血は企業により重篤と判断された。
2021/07/01 午前、本剤 1 回目の接種。
21530
皮下出血
接種直後、接種側腕の痛みが出現した。
接種当日 夕方、疲労感が出現した。
2021/07/02 頭痛が出現した。
接種後、症状後数時間で頭痛が回復した。
2021/07/03 から 2021/07/04 皮下出血が出現した。
254