資料1-2-3-2 薬機法に基づく製造販売業者からの副反応疑い報告状況について(スパイクバックス筋注・集計対象期間における基礎疾患等及び症例経過) (431 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
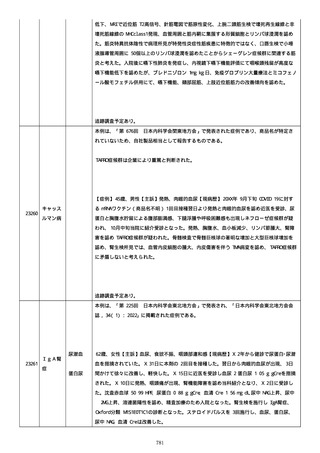
mg/日で治療を開始。
1 回目接種後の発熱、皮疹の転帰は、軽快。
2 回目接種後の発熱、両強膜炎、心筋梗塞、CRP 高値、手指の皮膚落屑、頭痛、血小板減少症
を伴う血栓症、肝機能障害の転帰は、未回復。多発冠動脈瘤、MIS-A の転帰は、不明。
報告者の協力が得られず、追跡調査不能。
本例は、「第 238 回
日本神経学会関東・ 甲信越地方会, 2021」で発表された症例であり、
商品名が特定されていないため、自社製品相当として報告するものである。
脳静脈洞血栓症は企業により重篤と判断された。
22248
大脳静脈
洞血栓症
54 歳の男性患者が、SRAS-CoV-2 に対する mRNA ワクチン(商品名不明)接種後に脳静脈洞血
栓症を認めた。処置、経過、転帰等の詳細は不明である。
患者の合併症及び併用薬の情報は不明である。
報告者の協力が得られず、追跡調査不能。
431