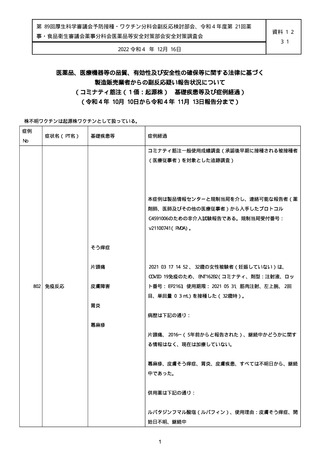
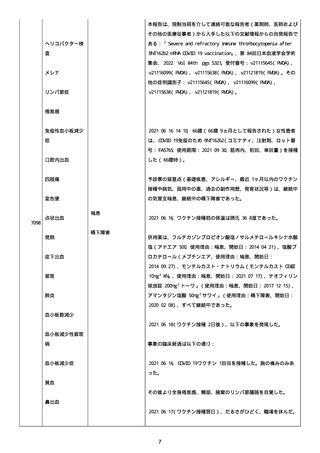
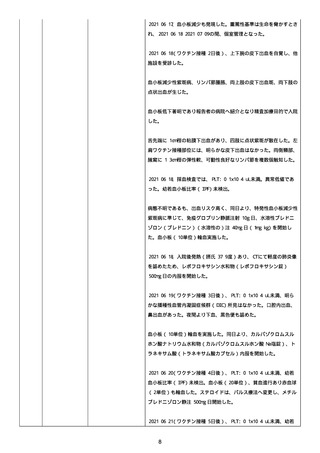
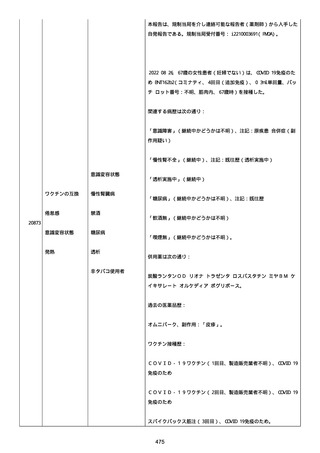
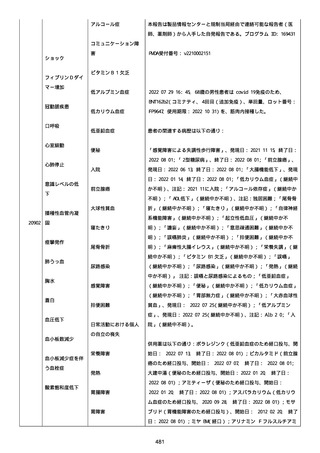
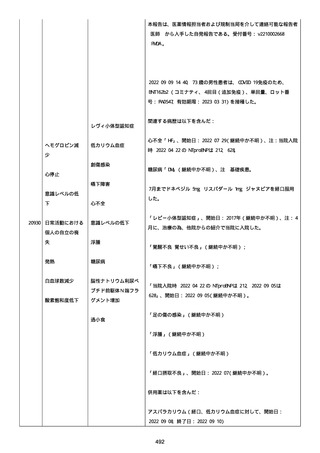
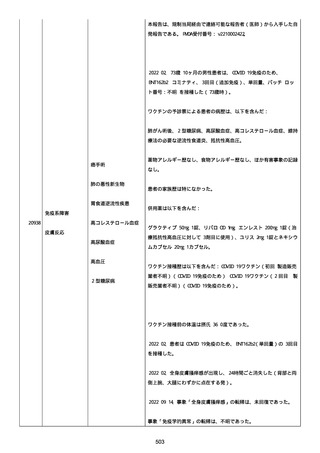
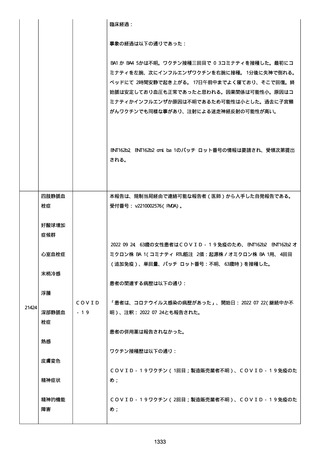
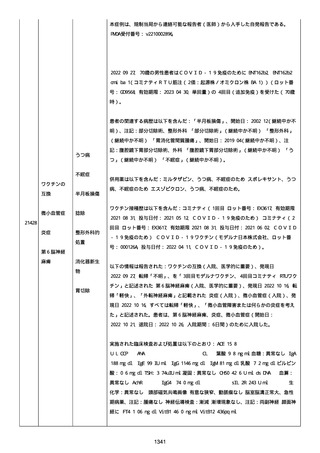
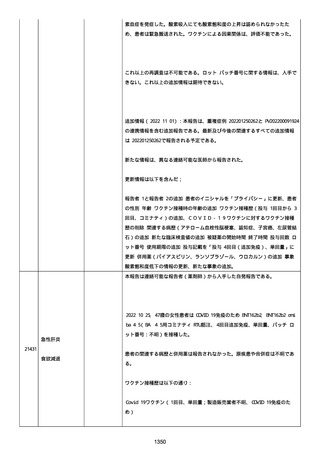
資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (1039 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
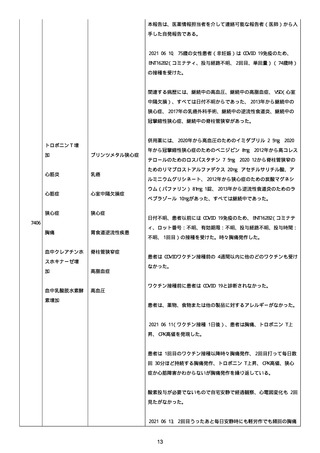
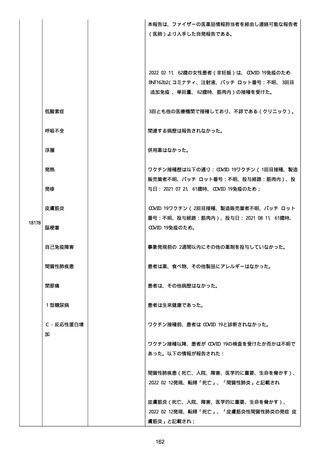
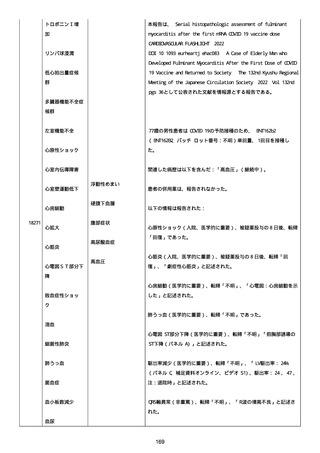
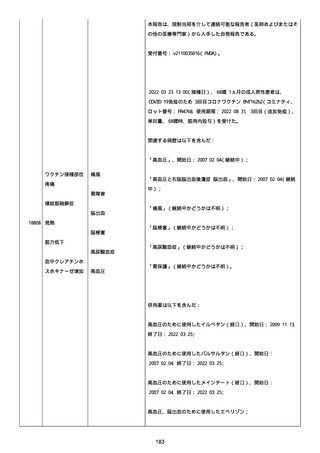
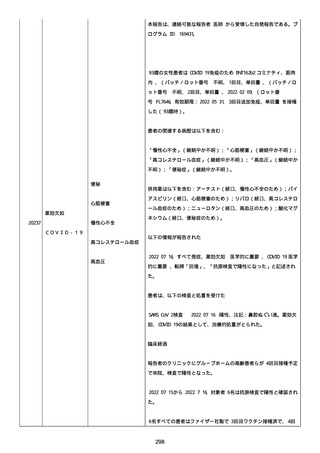
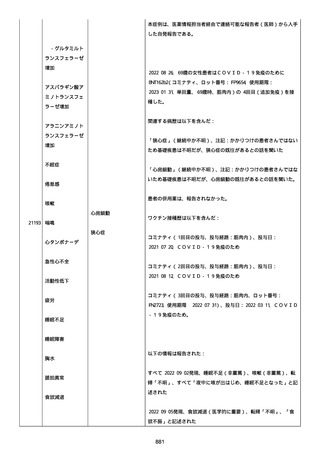
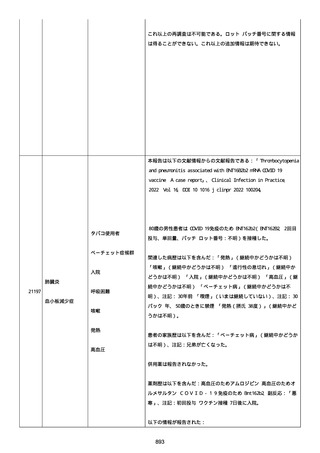
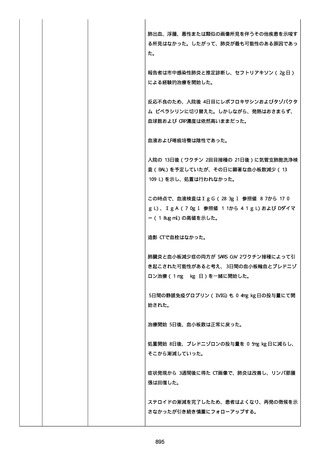
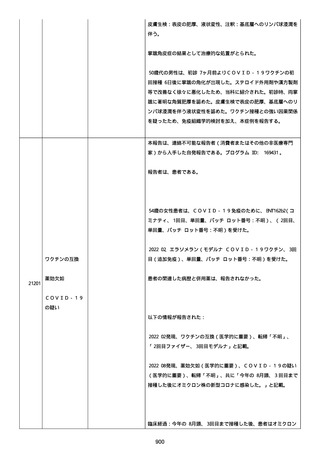
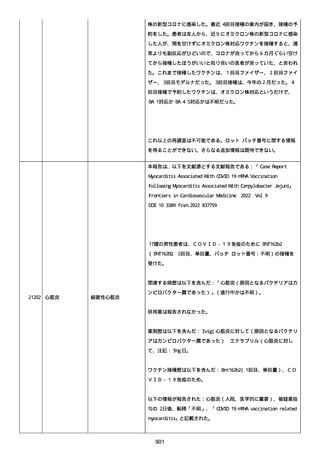
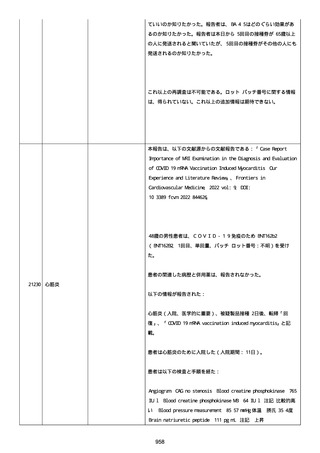
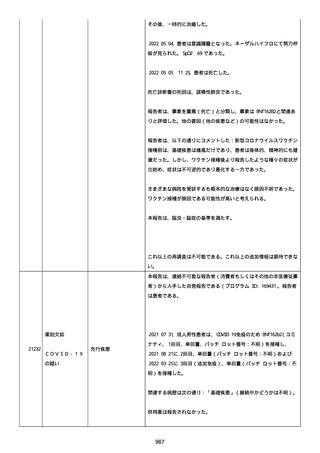
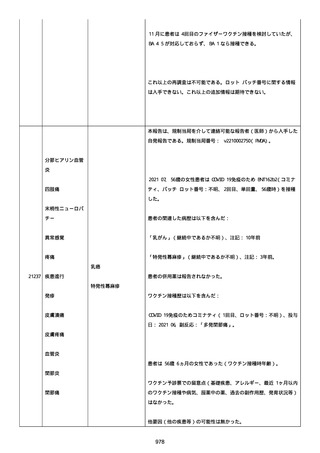
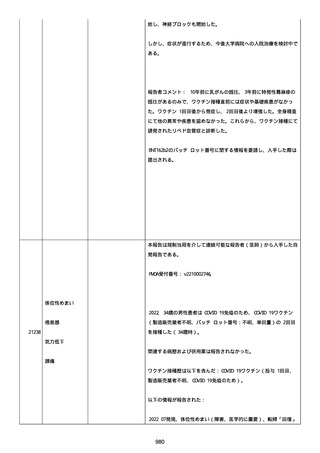
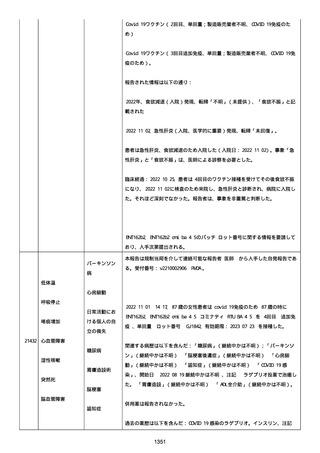
was markedly elevated」と記載された。
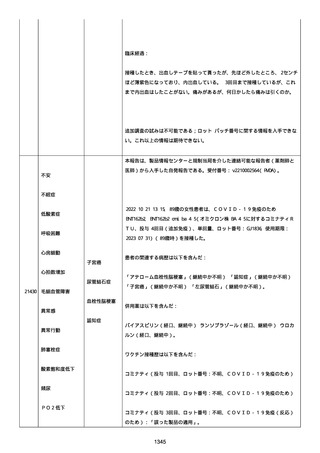
実施された臨床検査および処置は以下のとおり:
活性化部分トロンボプラスチン時間:37 秒;
抗リン脂質抗体(正常高値 1.3):1.0〜1.26;
血液検査:抗凝固薬終了後に示さなかった、注記:APTT、LA、aCL、
及び ab2GPI-IgG に有意な変化;
カルジオリピン抗体:39〜44 IU/ml、注記:2 年以上 aCL が中等度に
上昇;
44 IU/ml;
フィブリン D ダイマー:88.4 ug/ml;
正常値内、注記:1 回目接種後;
フィブリン分解産物:221.6 ug/ml;
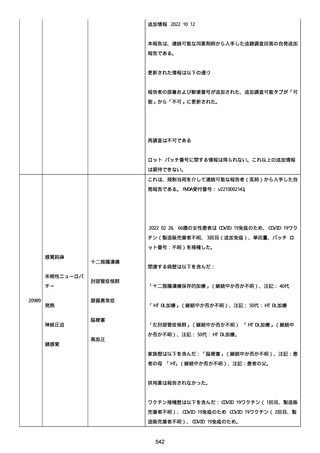
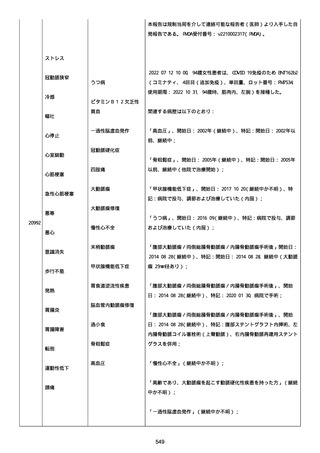
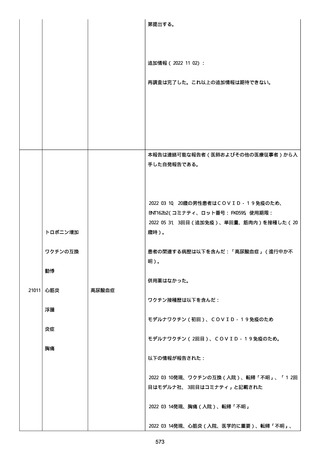
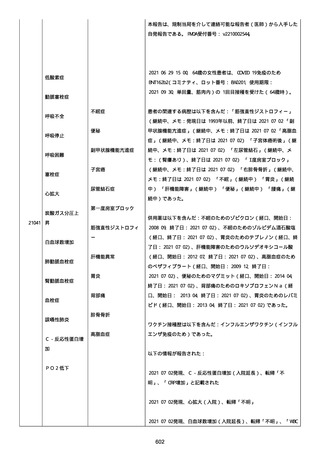
正常値内、注記:1 回目接種後;
抗β2 グリコプロテイン I IgG 抗体:0.7 未満;
プラスミンインヒビター:17.6 ug/ml;
血小板第4因子(正常高値 20):57 ng/ml、注記:8 年前;
282 ng/ml、注記:1 回目接種後上昇;
640 ng/ml、注記:1 回目接種の 2 ヶ月後;
350 ng/ml、注記:1 回目接種の 5 ヶ月後;
プロトロンビン時間:1.3;
トロンビン・アンチトロンビン III 複合体:49.1 ng/ml。
1039