資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (322 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
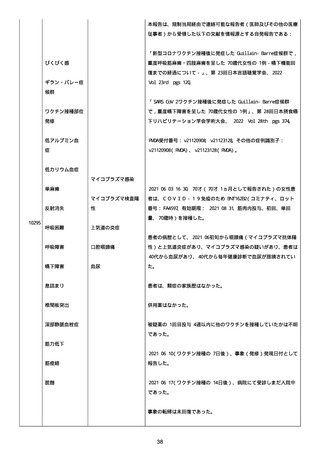
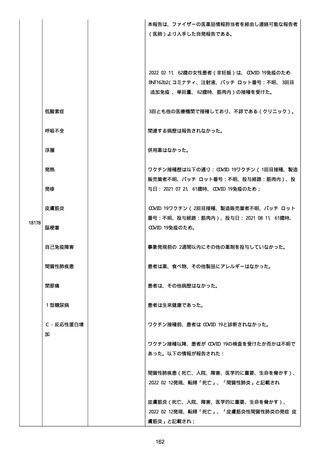
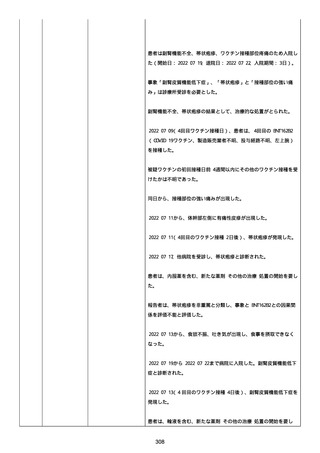
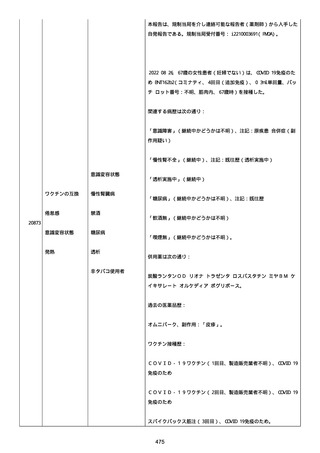
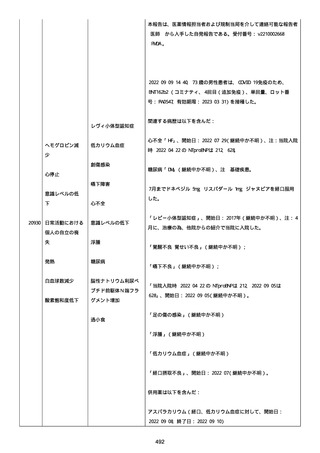
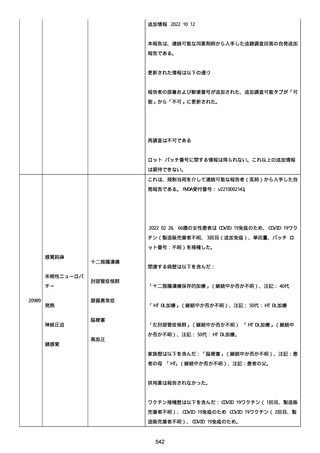
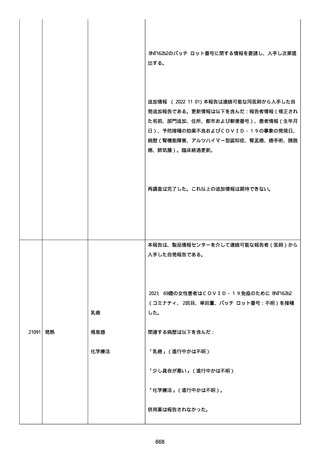
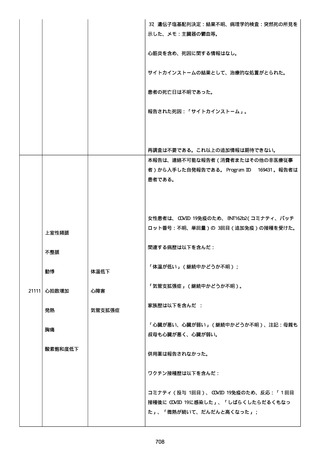
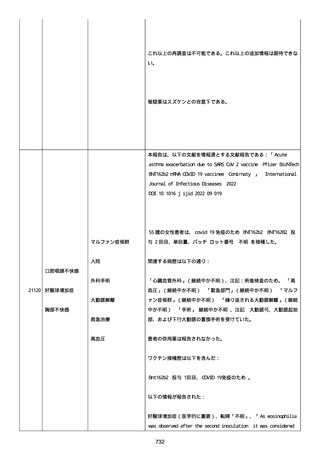
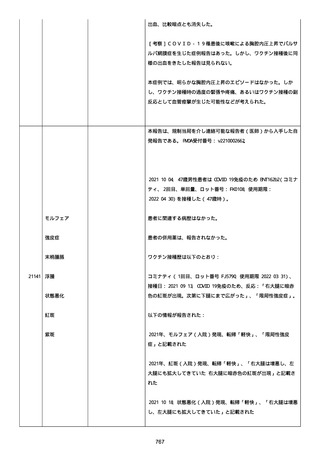
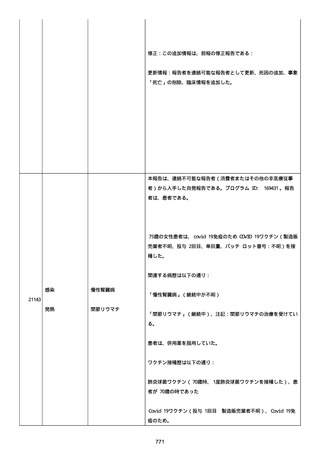
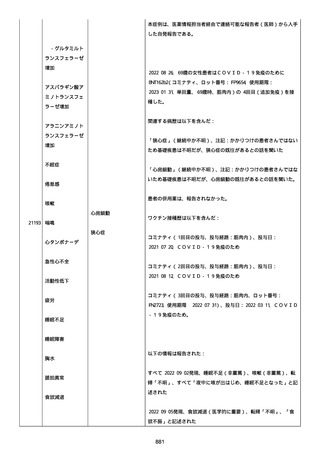
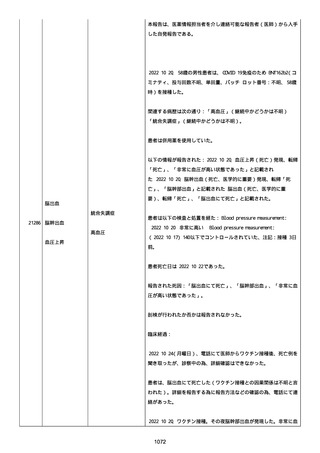
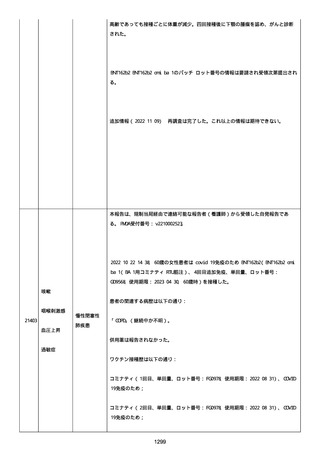
号 FL7646、使用期限 2022/05/31)の 3 回目単回量を、COVID−
19免疫のために接種した。
その他理由での追加免疫。(報告のとおり)。
COVID ワクチンの接種前 4 週間以内にその他のワクチン接種をしたか
は、不明であった。
病歴は以下の通り:
頸椎後縦骨化症(継続中)、開始日 2022/02/14;廃用症候群(継続
中)、開始日 2022/01/28;気管支喘息(継続中)、開始日
2015/08/07;慢性肺疾患(継続中)開始日 2015/06/13;肺気腫、開始
日 2015/02/16。
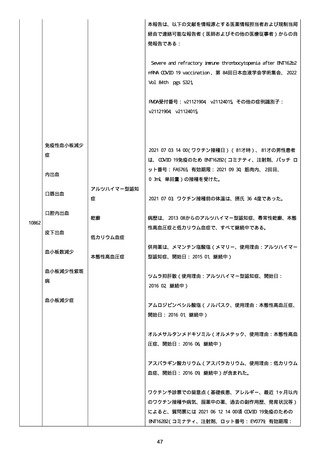
アレルギー/アレルギー歴、報告以外のワクチン接種歴、副反応歴は
不明であった。
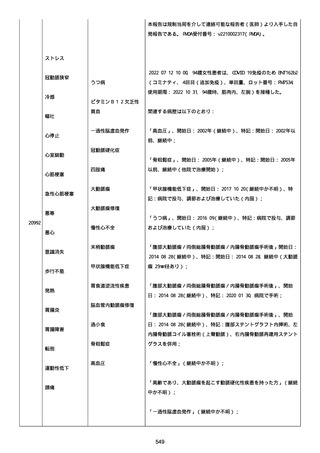
副作用歴に特になしであった。
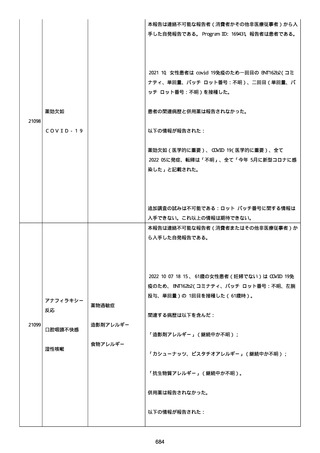
患者は、病院で生活していた。
ADL 自立度は、車イス介助であった。
嚥下/経口摂取は可能であった。
接種前後に異常はなかった。
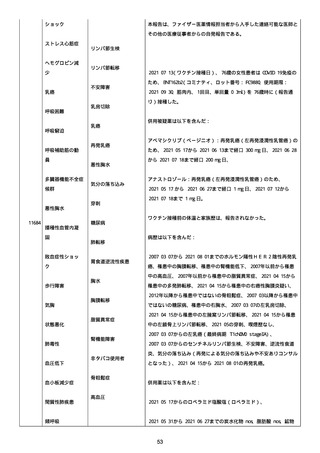
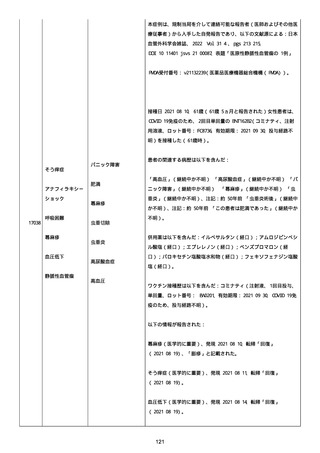
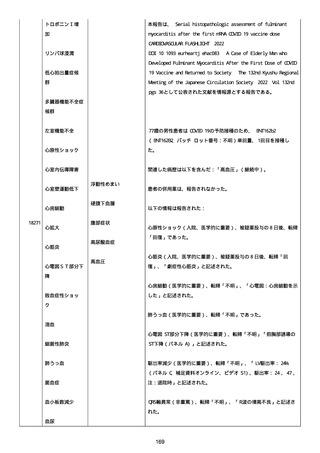
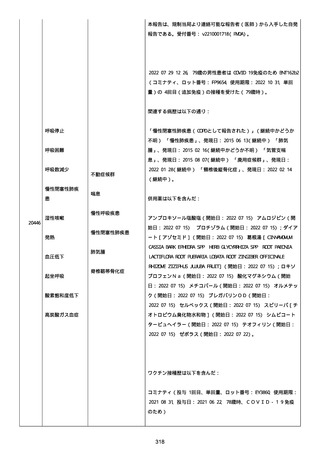
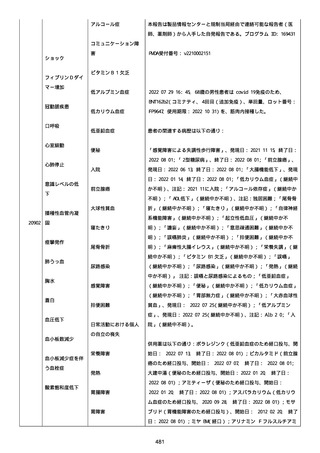
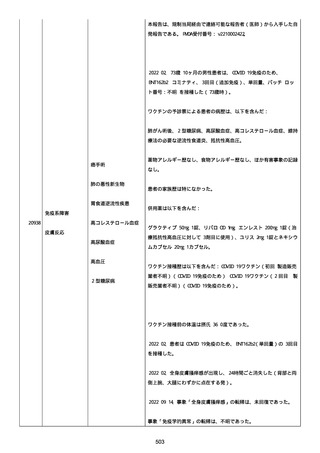
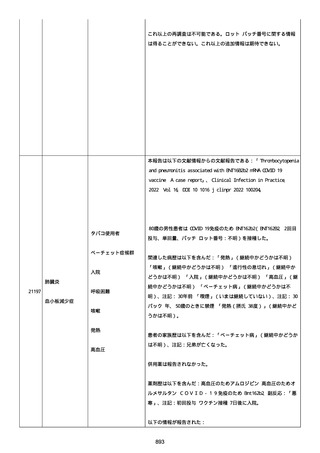
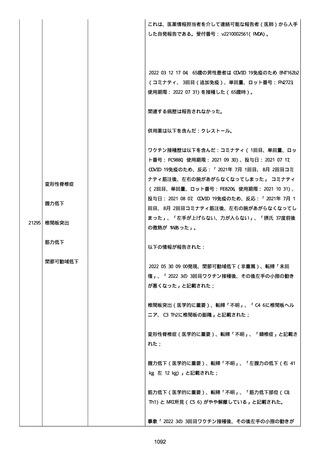
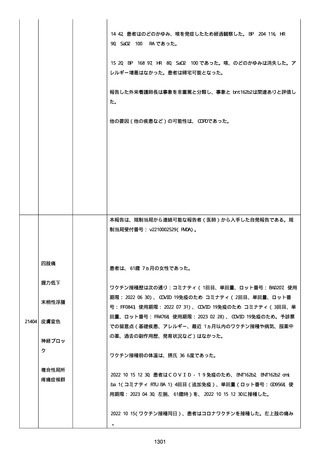
併用薬は以下の通り:
オルメテックOD錠 20mg、1 錠;アムロジピンOD錠 5mg[サン
ド]、1 錠;ダイアート 30mg、1 錠。1 日 1 回朝食後を 14 日間。服用
開始日は、2022/07/15 と 2022/07/29 であった。テオフィリン徐放カ
プセル 100mg[サンド]、4 カプセル(CP と報告された)。1 日2回
朝夕食後を 14 日間。
服用開始日は、2022/07/15 と 2022/07/29 夕であった。アンブロキソ
ール塩酸塩 15mg[アメール]、3 錠;セルベックス 50mg(3CP)。1
日 3 回毎食後を 14 日間。服用開始日は、2022/07/15 と 2022/07/29
322