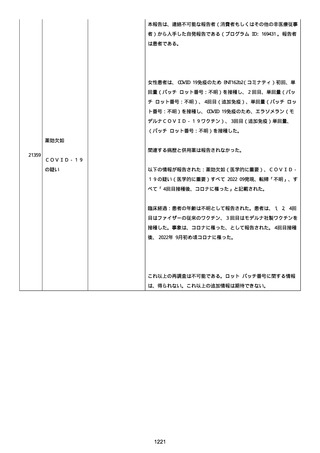
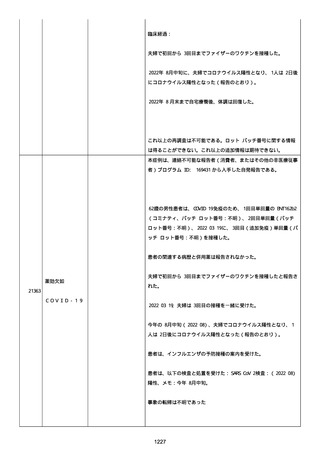
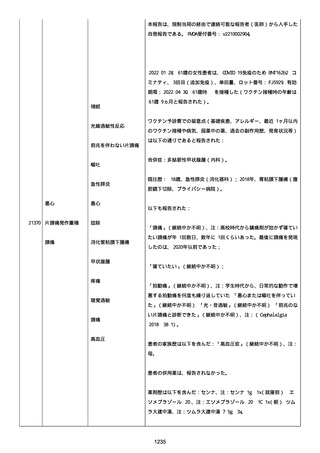
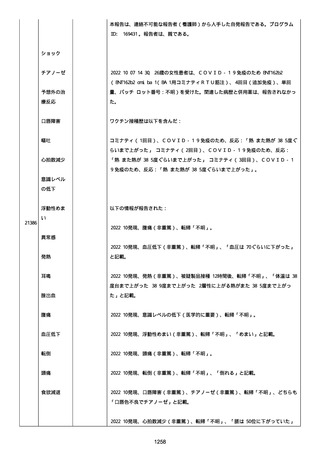
資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
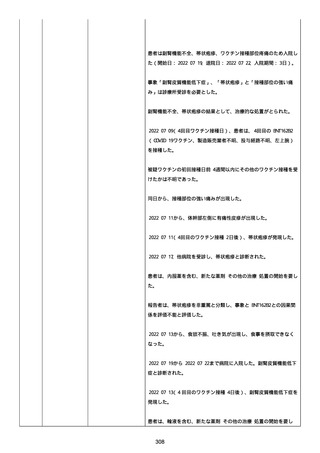
た。
臨床経過:本報告時点でCOVID−19ワクチン接種後後遺症の症
状は持続しており、被験者は外来受診を継続している。
患者にはアレルギーはなかった。患者には既往歴はなかった。
患者は妊娠もしくは授乳していなかった。
患者は、他のワクチン接種を受けなかった。
2022/04/21 現在、事象は未回復であった。
服用中の治療薬は次の通り
ドンペリドン錠剤、カロナール錠、ノバミン錠、アマージ錠、ツムラ
川きゅう茶調散エキス顆粒、ミグシス錠、セレコックス錠、ツムラ補
中益気湯、ツムラ五苓散、リフレックス錠、ツムラ半夏厚朴湯、ナウ
ゼリン坐剤、ビーフリード輸液、ビタメジン静注、プリンペラン注射
液、ソルデム 3A。
調査担当医師は事象コロナワクチン接種後後遺症を重篤(入院)と分
類した。
調査担当医師は有害事象と試験薬との因果関係について合理的な可能
性があるが、有害事象と併用薬との因果関係について合理的な可能性
はないと考えた。
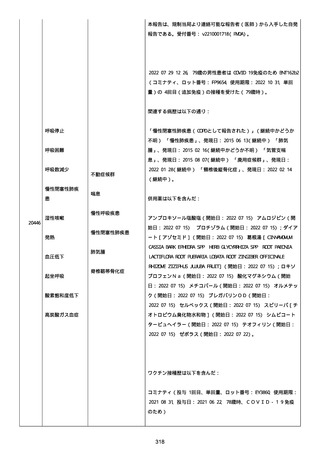
追加情報(2021/10/04):本追加報告は症例 2021384048 と
2021377290 は重複症例であったということを通知するものである。
以降すべての続報情報は、企業症例番号 2021377290 にて報告され
る。重複症例 2021384048 は医薬品医療機器総合機構(PMDA)の経由
で連絡可能な医師からの自発報告である。PMDA 受付番号:
v21100741。
2021/10/04 に試験の調査担当医師から入手した追加の新情報は下記
4