資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (868 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
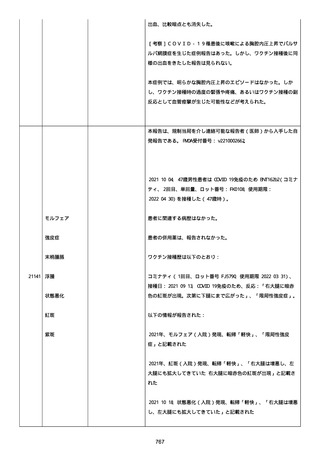
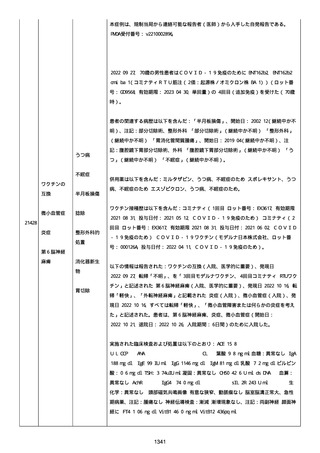
Myopericarditis After the Third Vaccination of BNT162b2 in a
Middle-Aged Man」、Cureus、2022; Vol:14(9)、pgs:e28857、
DOI:10.7759/cureus.28857。
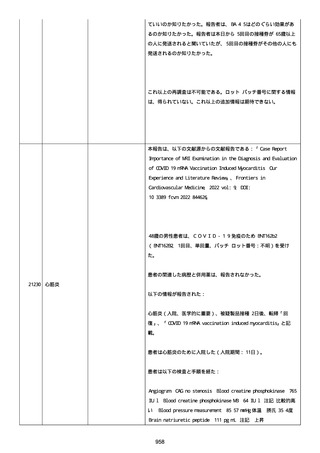
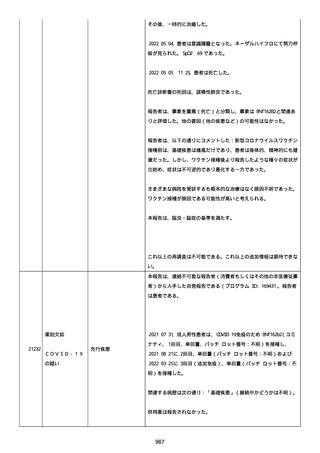
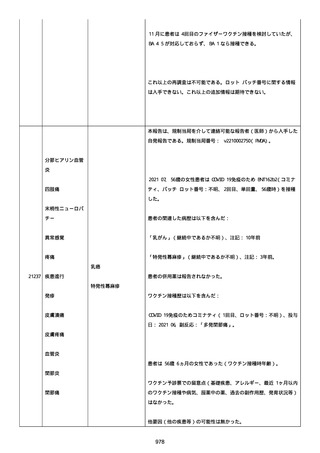
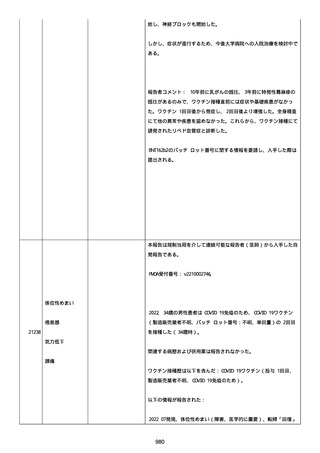
41 歳の男性患者は、COVID−19免疫のため BNT162b2
(BNT162B2、接種 3 回目(追加免疫)、単回量、バッチ/ロット番
号:不明)を受けた。
関連した病歴は以下を含んだ:
「喘息」(継続中かどうか不明)、注記:現在は治療を必要としてい
ないが、胸痛を訴えて当院の救急部門を受診した。
併用薬は報告されなかった。
ワクチン接種歴は以下を含んだ:
21187
心筋心膜炎
喘息
Bnt162b2(1 回目;製造販売業者不明、8 ヵ月前、COVID−19免
疫のため);
Bnt162b2(2 回目;製造販売業者不明、7 ヵ月前、COVID−19免
疫のため)。
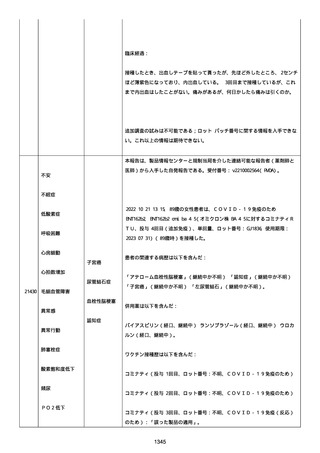
以下の情報が報告された:
心筋心膜炎(入院、医学的に重要、生命を脅かす)、転帰「軽快」、
「Acute Myopericarditis After the Third Vaccination of
BNT162b2」と記載。
患者は心筋心膜炎のため入院した(入院期間:4 日)。
患者は以下の検査および処置を受けた:
Alanine aminotransferase (6-35): 27, 注記: U/L; Aspartate
aminotransferase (10-33): 43, 注記: U/L; Blood creatine
phosphokinase (30-200): 264, 注記: U/L; Blood creatine
phosphokinase MB (25->): 21, 注記: U/L; Blood creatinine (0.61.0): 0.97 mg/dl; Blood lactate dehydrogenase (110-225): 187,
注記: U/L; Blood pressure measurement: 138/100 mmHg; Blood
868