資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (380 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
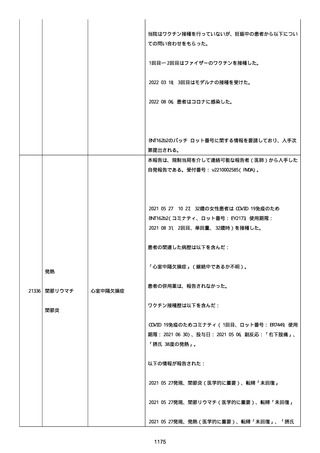
患者は安静時、重度の全身疾患を示す臨床徴候を示さなかった。
患者は酸素吸入(高流量又は ECMO を含む)または人工呼吸器を必要
としなかった。
COVID−19の罹患中に新たに発現した、又は悪化した症状/徴
候に関する情報は以下のとおり:
多臓器障害:いいえ、呼吸器:いいえ、循環器系:いいえ、消化器/
肝臓系:いいえ、血管系:いいえ、腎臓系:いいえ、神経系:いい
え、血液系:いいえ、外皮系:いいえ、その他:いいえ。
喫煙経験はなかった。
患者は、COVID ワクチン接種前の 4 週間以内にその他のワクチンを接
種しなかった。ワクチン接種 2 週間以内に薬剤の投与を受けなかっ
た。病歴はなかった。(ワクチン接種時のいずれの疾患も含む)。C
OVID−19ワクチン接種の前後に免疫調節薬又は免疫抑制薬によ
る治療、あるいは他のワクチンの接種を受けなかった。関連する検査
を受けなかった。患者は、組織的または職業的にコロナウイルスへの
曝露頻度が高いリスク(および重篤なCOVID−19合併症のリス
ク)に起因する追加免疫のための投与を受けた。
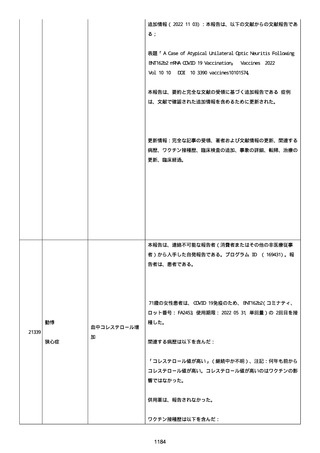
結果:調査および/または薬効欠如のため、このロットの有害事象安
全要請が以前に調査された。関連するバッチのリリース後6カ月以内
に苦情が受け取られてから、活性成分の量を決定するために QC 研究
室に送られなかった。すべての分析結果はチェックされ、登録された
限度の範囲内であった。参照 PR ID の調査は、以下の結果となった。
「PFIZER-BIONTECH COVID−19ワクチン」に対する苦情が調査
された。調査には、関連するバッチ記録、逸脱調査、報告されたロッ
トおよび製品タイプの苦情歴の分析が含まれた。最終的な範囲は報告
されたロット EY2173、ロット ET3674 とロット FJ1763 であると決定
された。苦情サンプルは返却されなかった。調査中、関連した品質問
題は特定されなかった。製品品質。規制、バリデーション、安定性へ
の影響はなかった。プールス製造所は報告された欠陥がバッチの品質
を代表するものではなく、バッチは引き続き許容可能であると結論付
けた。
380