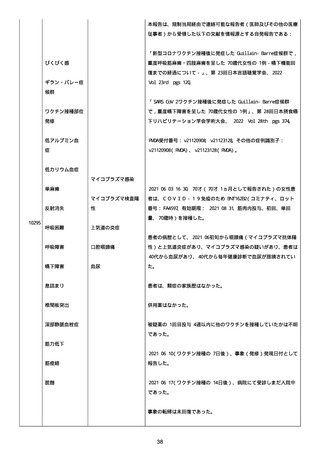
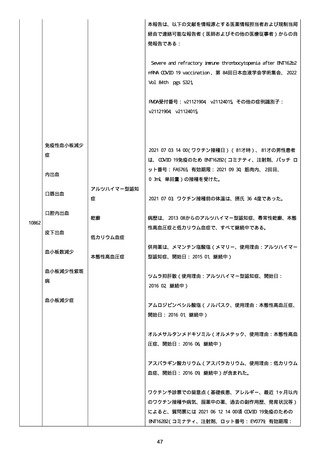
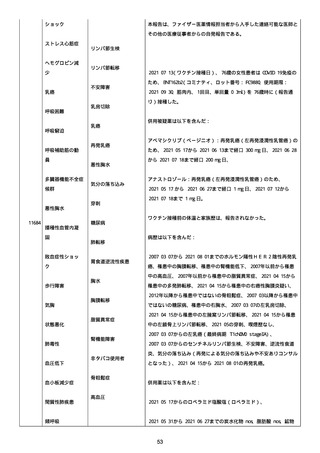
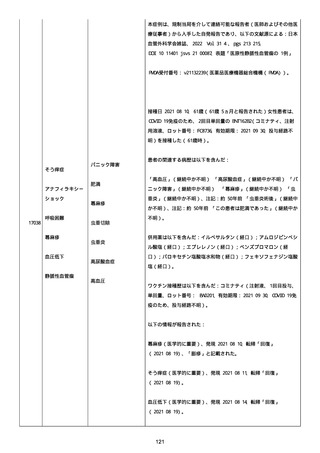
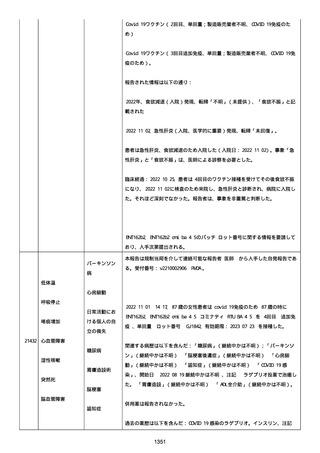
資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (1189 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
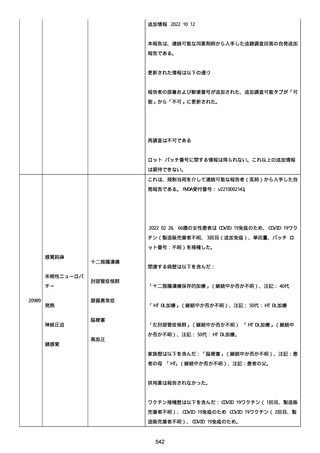
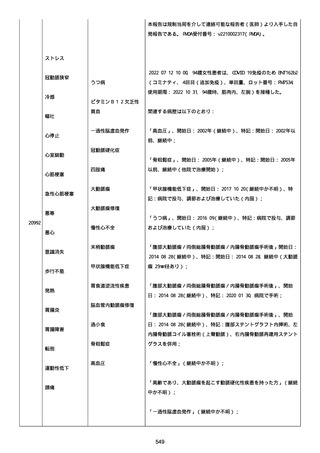
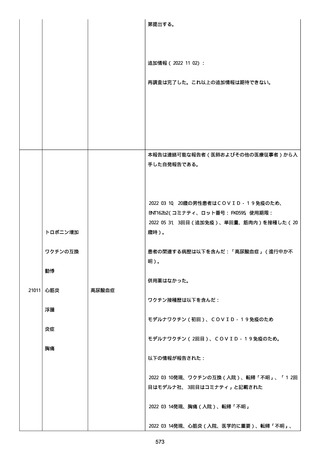
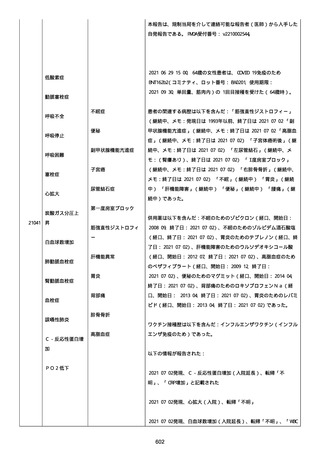
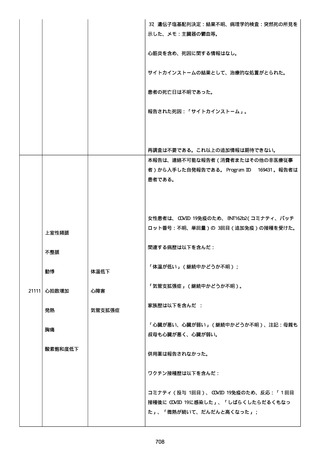
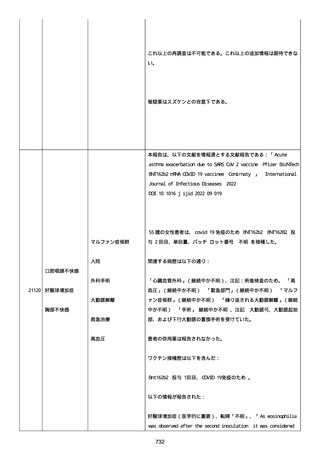
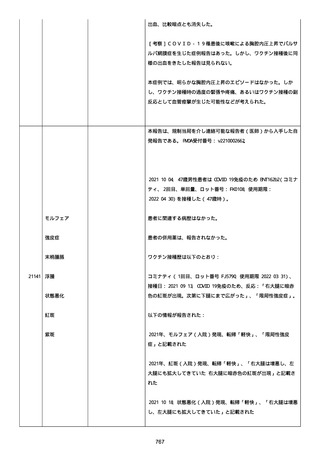
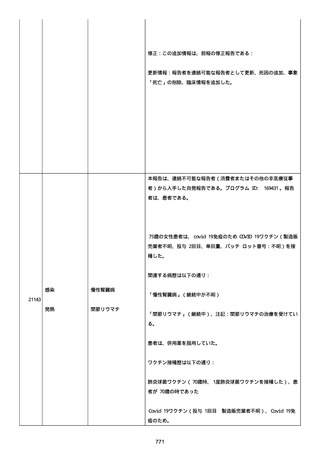
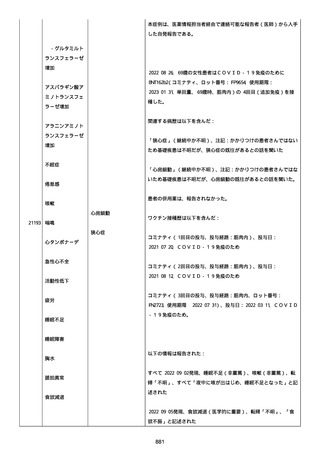
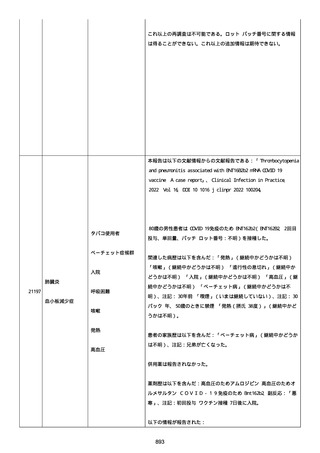
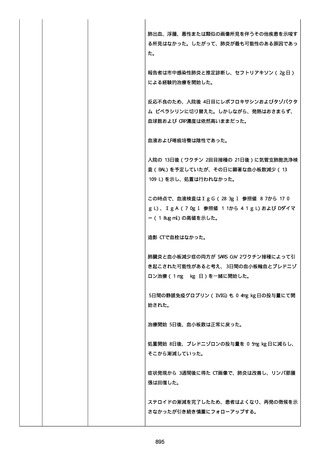
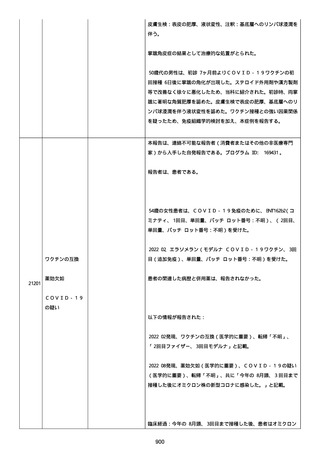
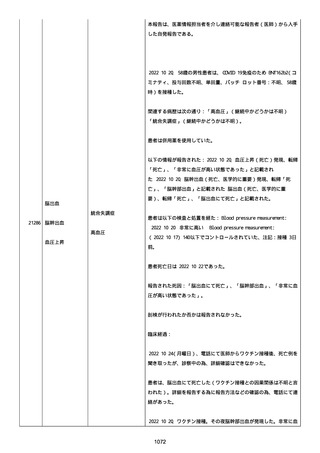
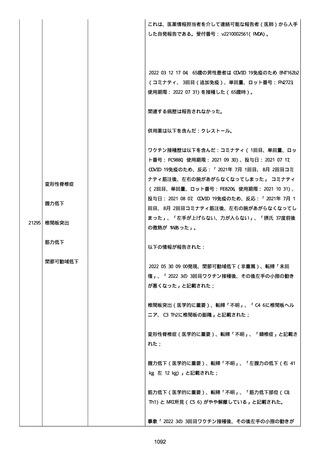
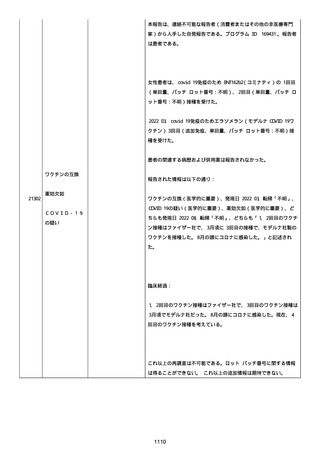
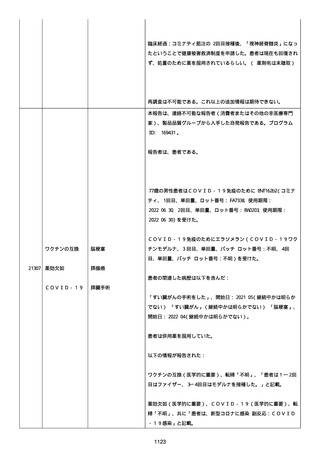
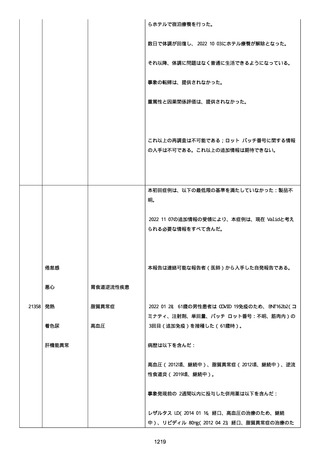
イルス検査 (正常高域 0.005): 0.005 未満; C型肝炎ウイルス検査:
1.0 未満、注記: COI; High density lipoprotein (40-96): 30
mg/dl; 組織学的検査: 皮膚生検がわずかな浸入を示した、メモ:皮
膚血管系周囲のリンパ球; 免疫学的検査: 免疫グロブリン G
(IgG)、IgA、IgM の沈着なし、注記: および補体; 結果不明; 第
XIII 因子活性(0.76-1.55): 0.03 IU/ml; 要因 XIII/13 抗原(正常低
域 70): 15%; Immature platelet fraction: 13.9 %; 免疫クロマト
グラフィー:結果不明; Thrombomodulin (12.1-24.9): 21.8 IU/ml;
Lymphocyte count (18.0-59.0): 18.5 %; Monoblast count (0-8.0):
6.5 %; Neutrophil count (40.0-74.0): 69.3 %; 身体的診察:触知
可能紫斑病を上肢に認めた、注記:下肢; Plasmin inhibitor (85115): 110 %; Plasmin inhibitor: 1.4 ug/ml; Plasminogen (75125): 105 %; Plasminogen activator inhibitor: 20 ng/ml;
Platelet count (13.0-36.9): 39 x10 3/mm3; Protein total (6.78.3): 6.6 g/dl; Prothrombin index (0.85-1.15): 1.04; SARS-CoV2 抗体検査: 561.1、注記: AU/mL; レンサ球菌検査: 22 IU/ml;
Thyroglobulin (50-149): 95 mg/dl; 総補体価測定(25.0-48.0):
53.4 IU/ml; 超音波スキャン: 血栓症は認めなかった; 尿検査: 2+;
(-); 尿検査(正常高域 150): 1668 mg/g; 3+; フォンウィルブランド
因子活性測定(60-170): 242 %、注記: 患者; 68 %、 注記: 健常者;
196 %、注記: 1:1 混合; フォンウィルブランド因子抗原測定(50155): 185 %;フォンウィルブランド因子多量体測定: 通常のパター
ン; White blood cell count (3,500-9,100): 7720 uL。
紫斑の結果として、治療的な処置がとられた。
これ以上の再調査は不可能である。これ以上の追加情報は期待できな
い。
1189