資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (341 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
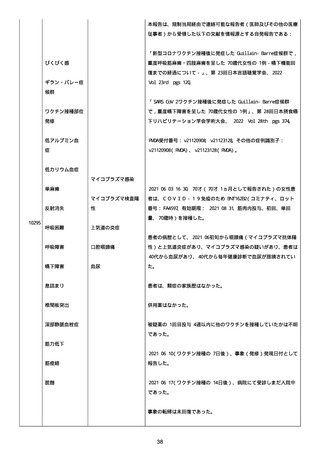
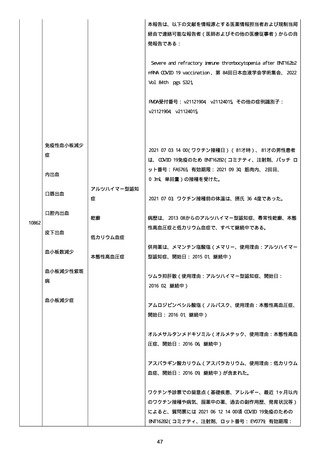
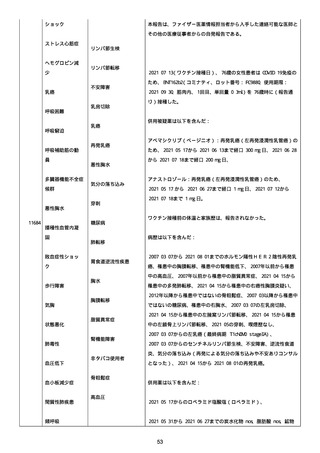
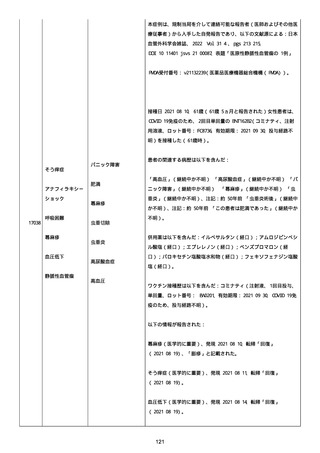
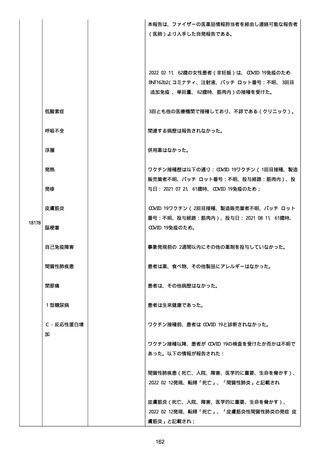
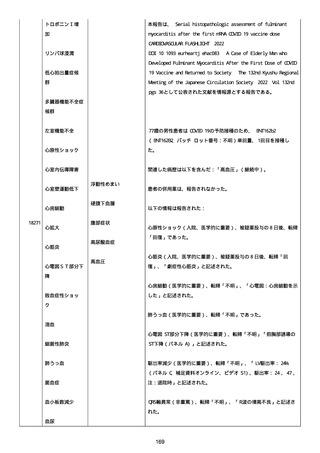
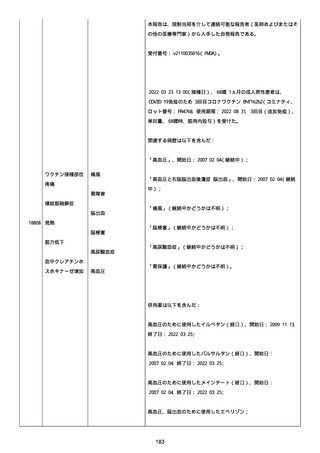
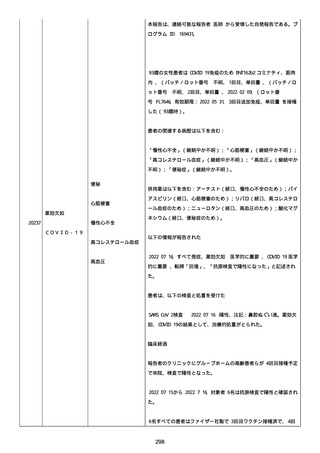
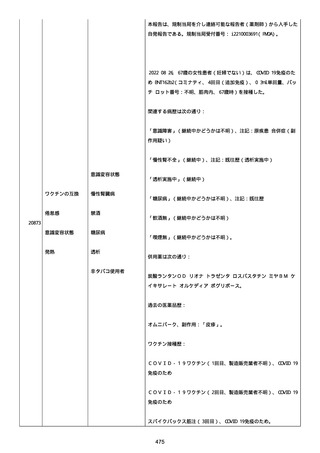
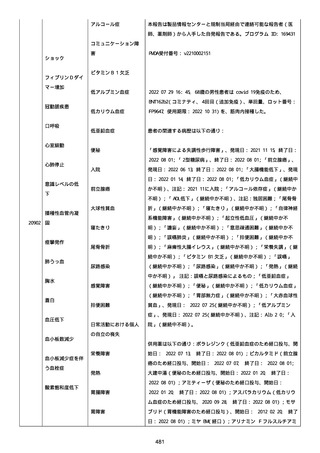
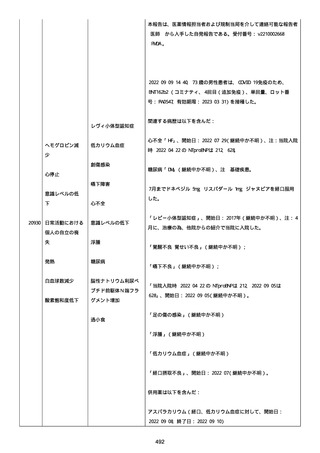
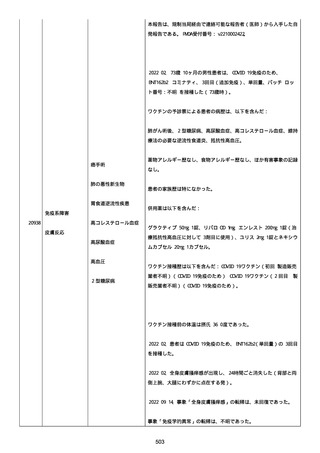
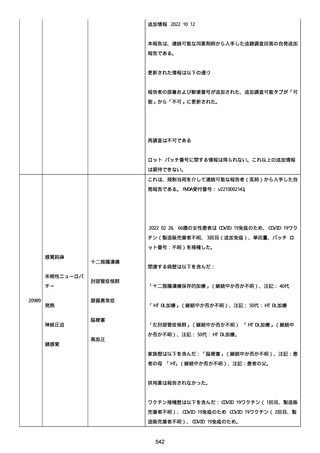
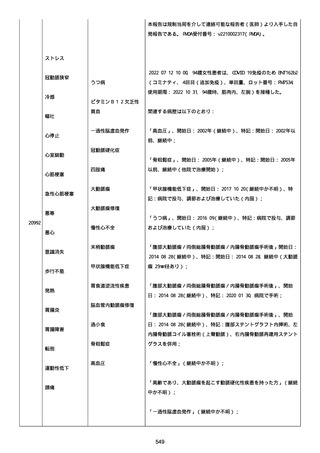
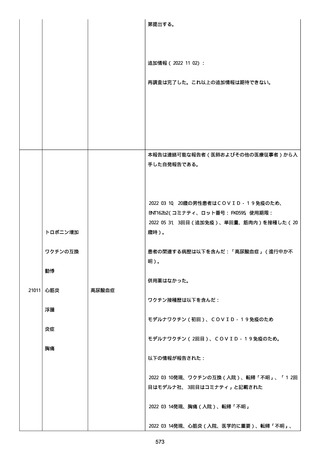
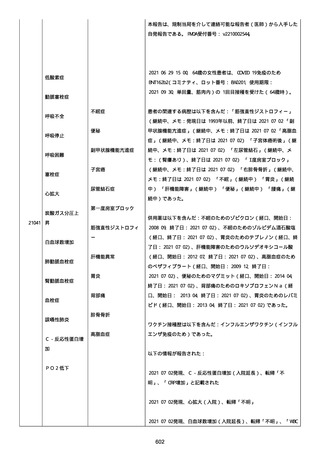
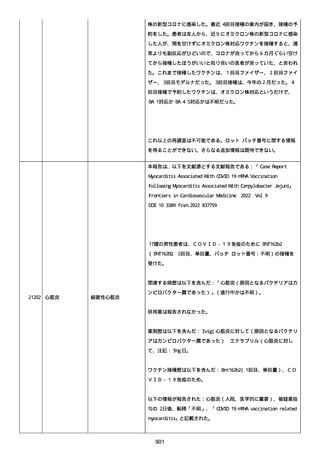
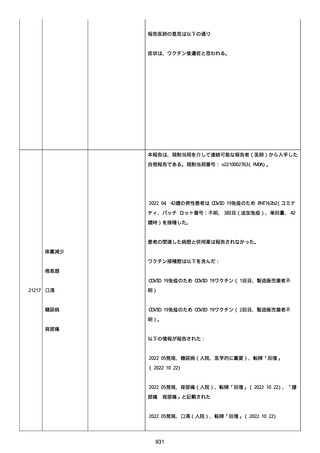
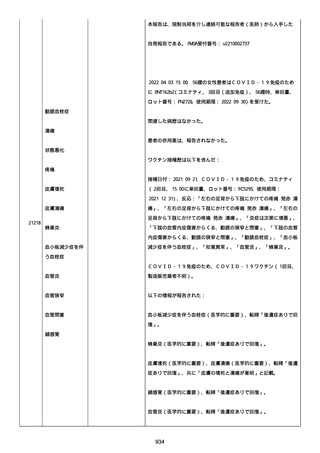
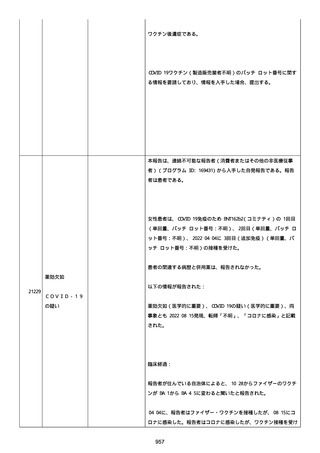
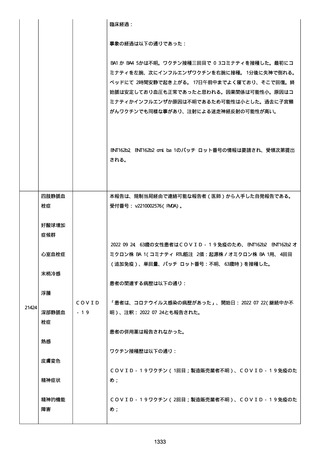
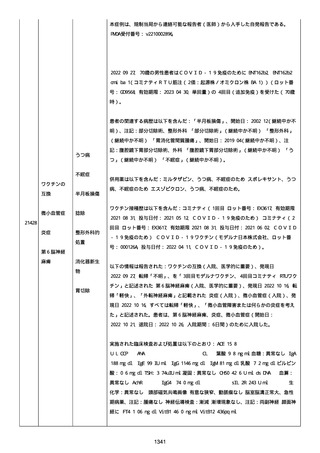
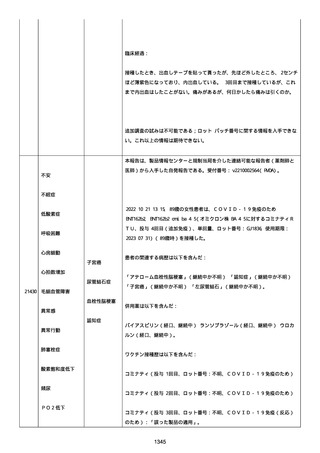
2022/08/06:
12:22、フェキソフェナジン 120 mg を内服した。
12:52、アドレナリン 0.3 mg を左大腿に筋肉内注射した。
患者に多臓器関連、呼吸器、心血管系、皮膚/粘膜;消化器;その他の
症状/徴候があったかどうかは不明であった。
以下の検査を実施したかどうかは不明であった:
肥満細胞トリプターゼ、免疫マーカー(例、総 IgE 値)、補体活性化
試験、血液検査、生化学的検査、その他関連する検査。
患者には特定の製品に対するアレルギーの既往歴又はアレルギーを示
す症状があるか?薬物(サワシリン)。
患者が有害事象の報告前に他の何らかの疾患に対し最近ワクチン接種
を受けたかどうかは不明であった。
患者が有害事象の報告前に Pfizer-BioNTech COVID-19 ワクチンのワ
クチン接種以外に最近 SARS-CoV2 のワクチン接種を受けたかどうかは
不明であった。
患者が Pfizer-BioNTech COVID-19 ワクチンのワクチン接種の前後に
他のワクチン接種を受けたかどうかは不明であった。
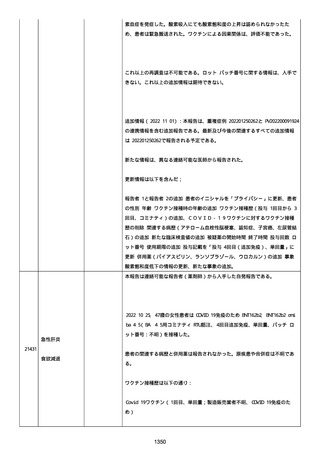
修正:
本追加情報は、前報の修正報告である:
経過を更新した。
追加情報(2022/08/18):
再調査は完了した。これ以上の追加情報は期待できない。
341