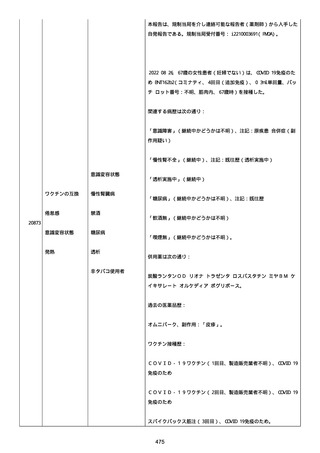
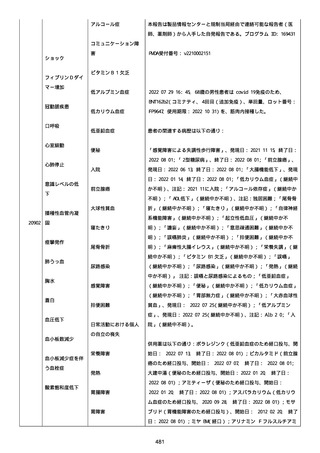
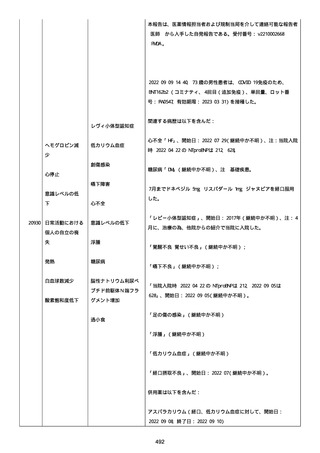
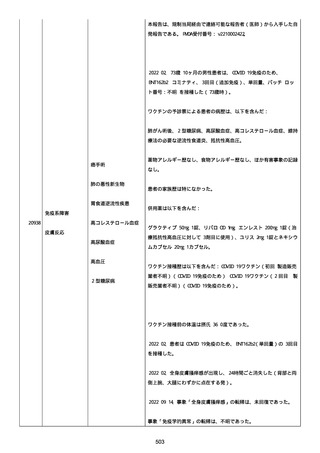
資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
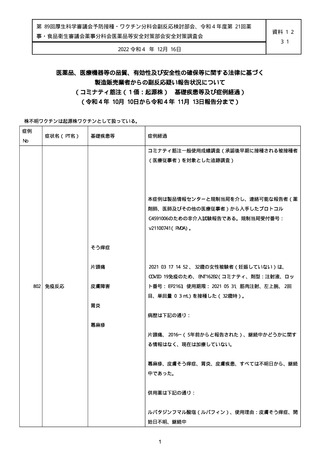
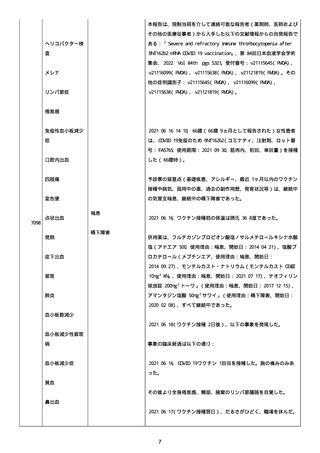
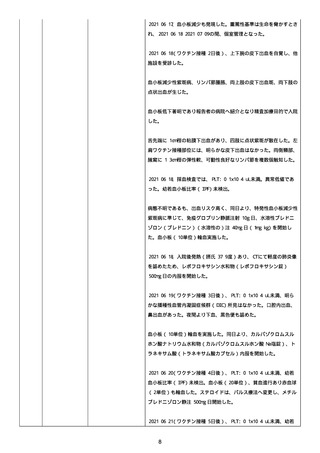
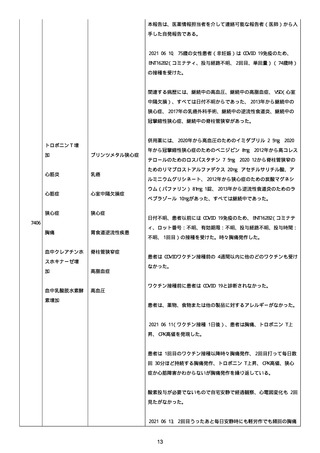
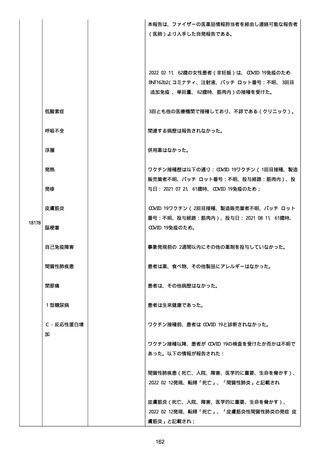
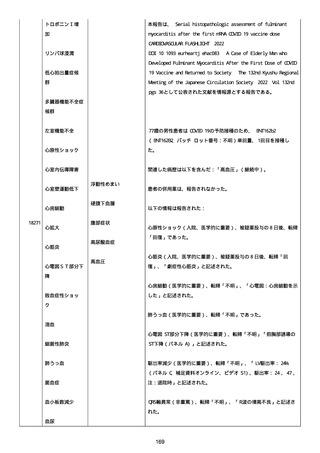
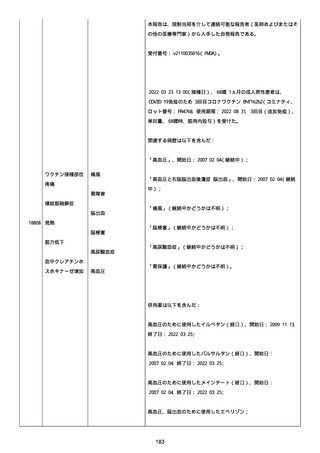
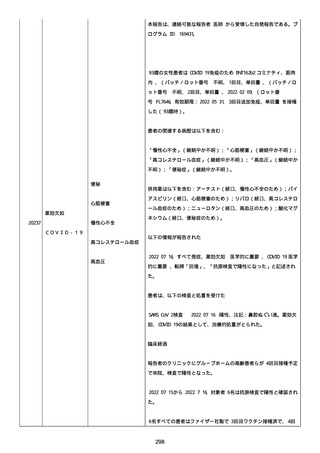
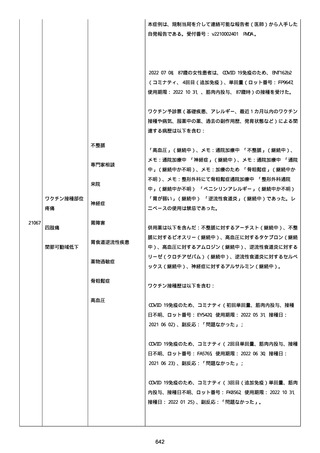
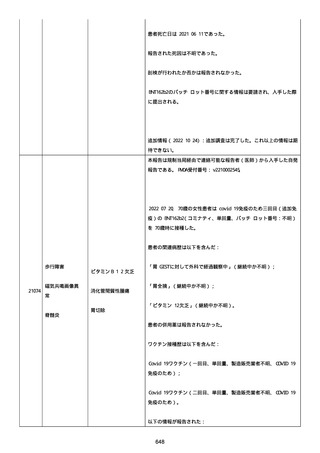
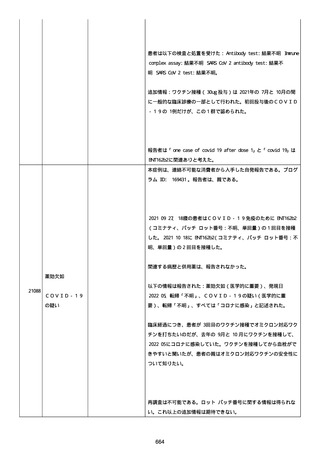
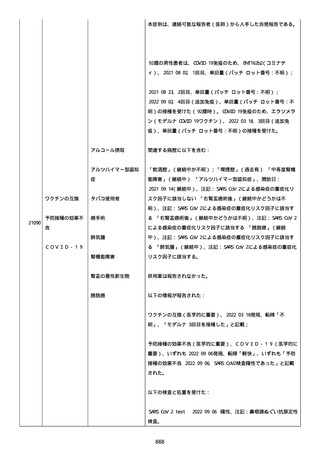
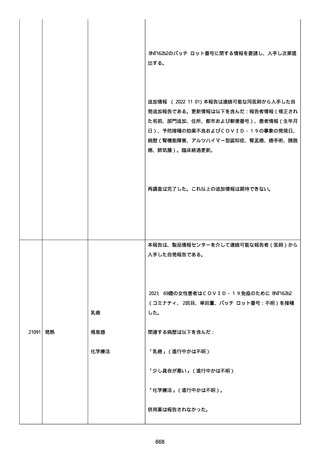
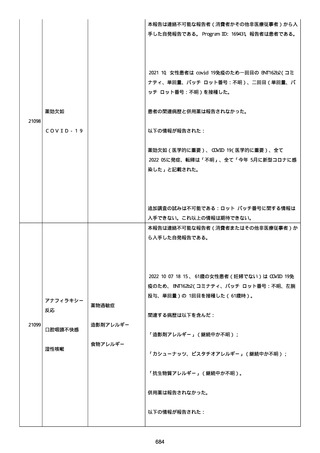
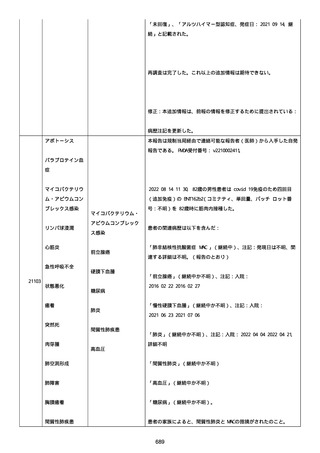
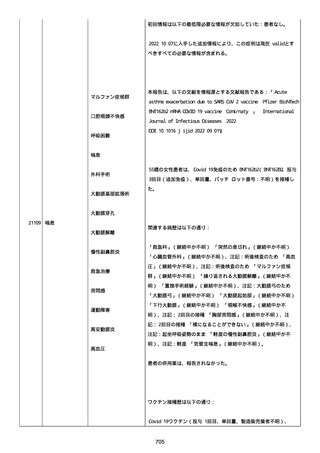
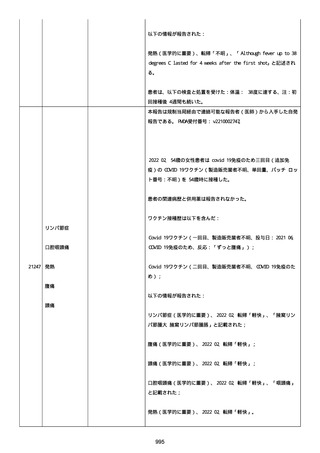
なった。
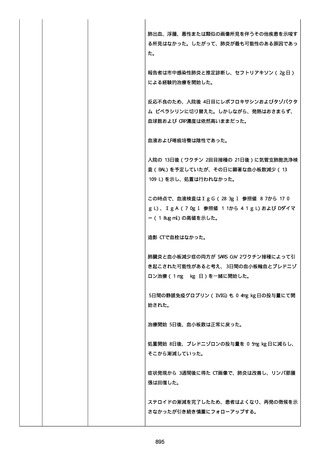
報告の時点、頭痛、悪心、食欲不振は継続していた。
調査担当医師はコロナワクチン接種後後遺症を事象名として提供し
た。
臨床検査および処置は下記の通り:
2021/03/17、体温は 35.5 度であった。
関連する検査は以下の通りであった:
2021/03/22 頭部MRIの結果は異常なしであった。
2021/04/08 髄液検査の結果は異常なしであった。多形核白血球数 2、
単球 6 がコメントに示された。
2021/04/06 生化学的検査と血液検査の結果は異常なしであった。
CRP:0.02 がコメントに示された。
他院に入院中、自己抗体(甲状腺、ビタミン)、神経伝導速度と胃内
視鏡検査の結果は、異常なしであった。
血小板減少症に伴う血栓塞栓症が発現している場合の検査はなかっ
た。
事象の報告前に他の何らかの疾患に対し最近ワクチン接種を受けなか
った。
報告前に Pfizer-BioNTech COVID-19 ワクチン以外に最近 SARS-CoV2
のワクチン接種を受けなかった。
Pfizer-BioNTech COVID-19 ワクチン接種の前後に他のワクチン接種
を受けなかった。
事象(コロナワクチン接種後後遺症、頭痛、嘔気/悪心、嘔吐、発
熱)に対して治療を受けた。
事象の転帰は未回復であった。
3