資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (749 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
LITERATURE REFERENCE:
Hosoi H, Tane M, Kosako H , Ibe M, Takeyama M, Murata S,
et.al. Acute-type acquired hemophilia A after COVID-19 mRNA
vaccine administration: A new disease entity. J Autoimmun.
2022;133:102915
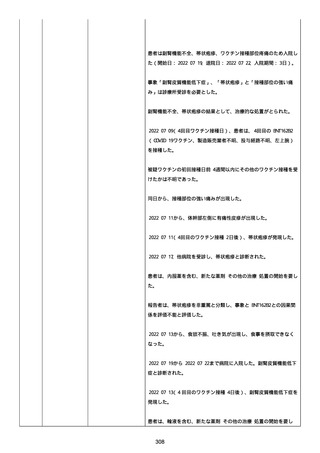
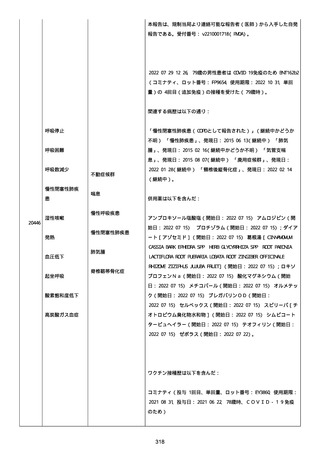
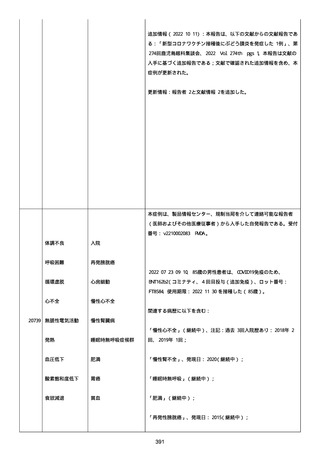
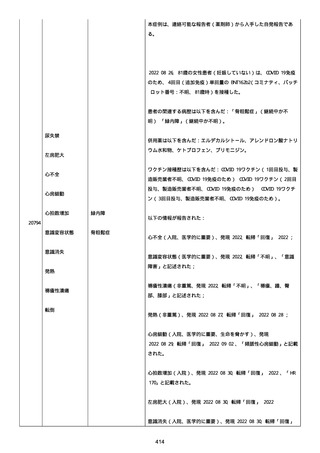
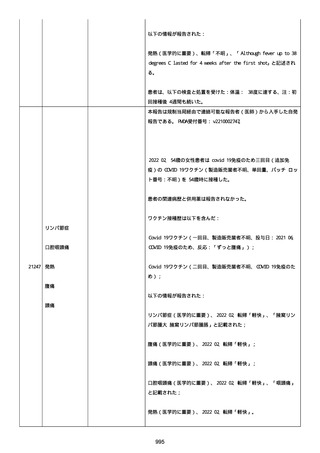
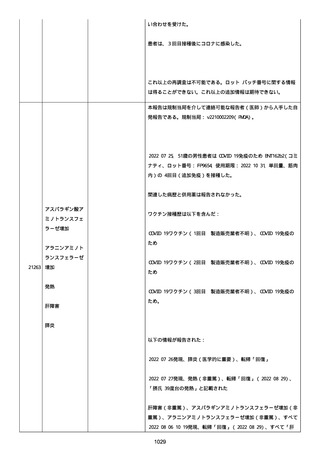
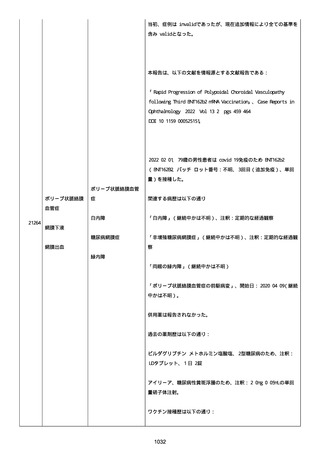
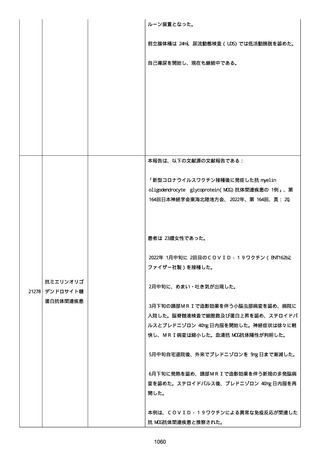
既往歴は妊娠(5 年前)。
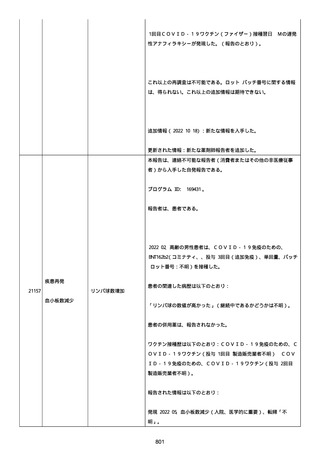
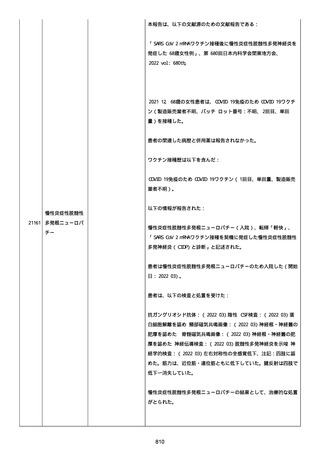
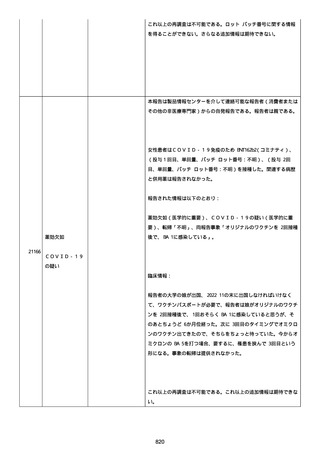
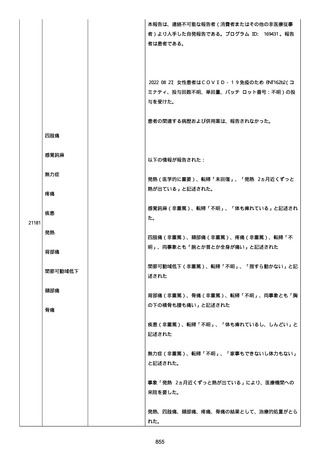
日付不明
ファイザー1 剤形の 2 回目の投与を受けた。
21128
後天性血友病
妊娠
本剤 1 剤形の 3 回目の投与を受けた。
日付不明
後天性血友病、ワクチン製品の相互利用及び COVID-19 免疫が発現。
抗第 VIII 因子抗体陽性の後天性血友病 A に対してプレドニゾロンを
1 mg/kg(50 mg/body)投与した。
本報告時
後天性血友病(後天性血友病 A)は回復しており、ワクチン製品の相
互利用及び COVID-19 免疫の転帰は不明であった。
〇年 3 月
COVID-19 接種。
軽度の鈍的外傷により皮下出血を発症した。
749