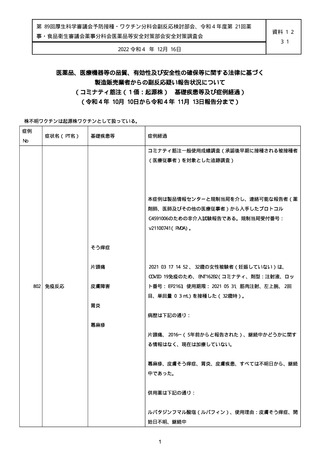
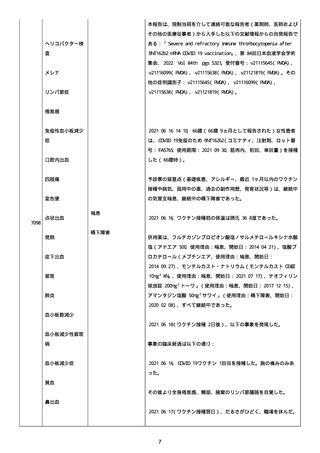
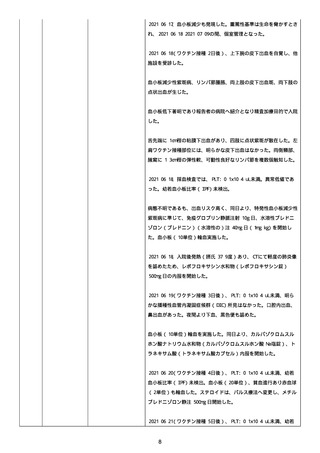
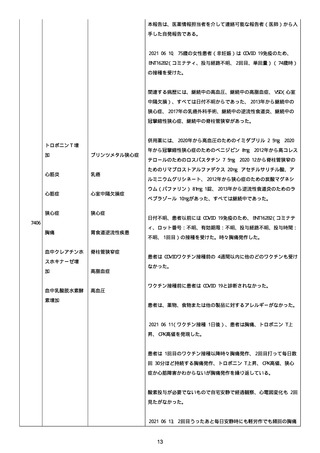
資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (57 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
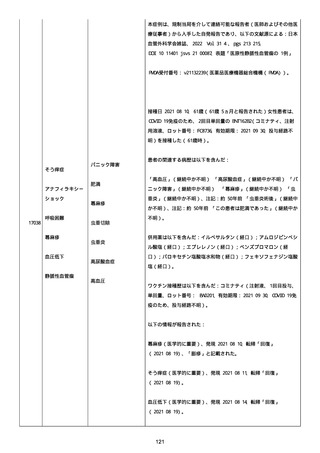
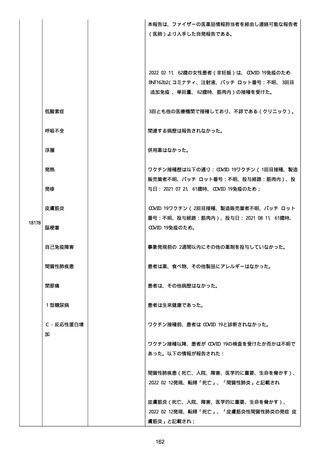
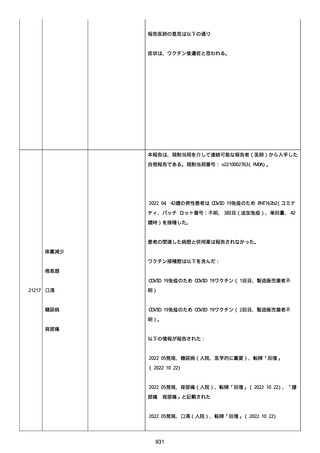
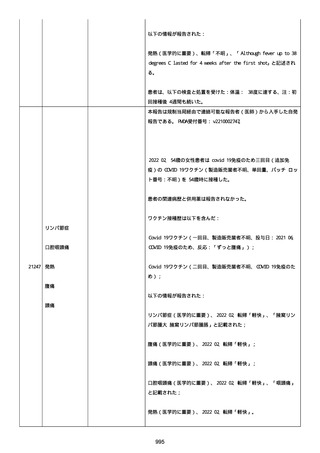
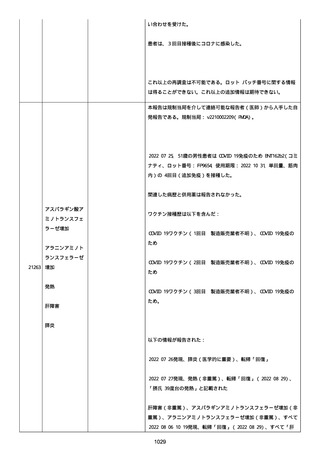
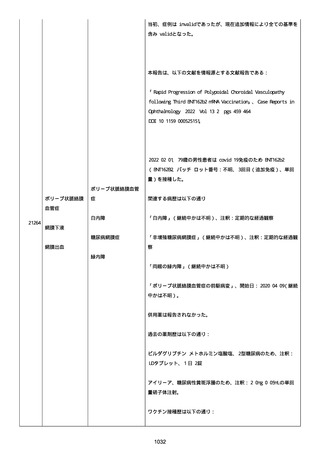
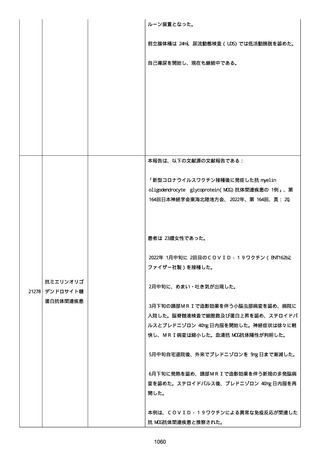
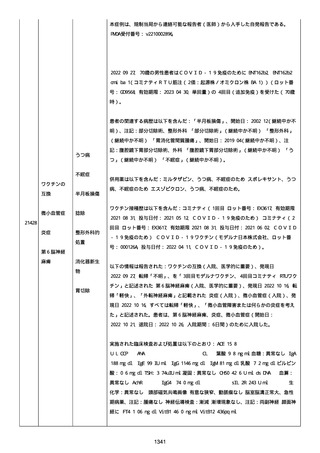
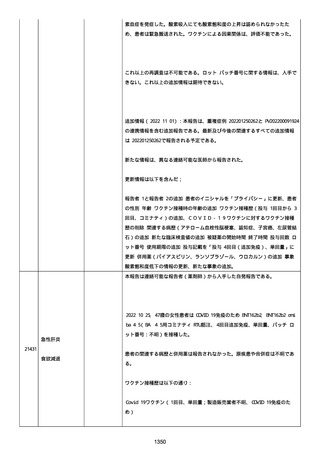
感とその他初期症状はなかった。アベマシクリブを投与中止した。
2021/07/18、アナストロゾールを投与中止した。
2021/07/19(発現日)、労作時呼吸困難と呼吸不全は出現した。患者
は体調不全のために外来受診した。
CT にて左肺にすりガラス状陰影、両肺全葉に間質影と蜂巣状陰影
(びまん性肺胞障害(DAD パターン))があった。
インフルエンザ A 陰性、インフルエンザ B 陰性、COVID-19 抗原検査
陰性、COVID-19PCR 検査陰性、尿中レジオネラ抗原陰性、尿中肺炎球
菌陽性。
呼吸機能検査、気管支肺胞洗浄検査、肺生検は実施されなかった。心
臓超音波検査および薬剤誘発性リンパ球刺激試験実施の有無に関する
情報は得られていなかった。
薬剤性肺炎疑いにて入院した。
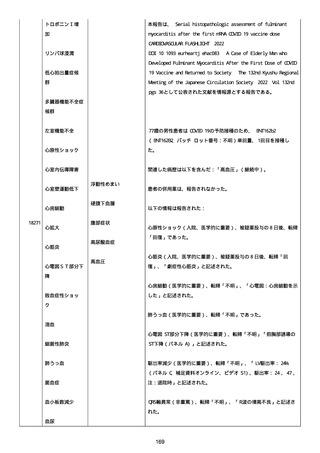
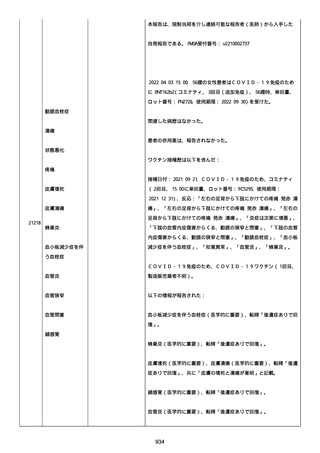
SpO2:87%(室内空気)、CRP:5.73mg/dL、WBC: 7400/uL、Neut:
6400、Lymph: 800、Hb: 9.5 g/dL、Plt: 159000/ul、BUN: 15.8
mg/dL、eGFR: 36.2 ml/min/1.73m2、SP-D: 93.6 ng/mL(基準値: 93.6
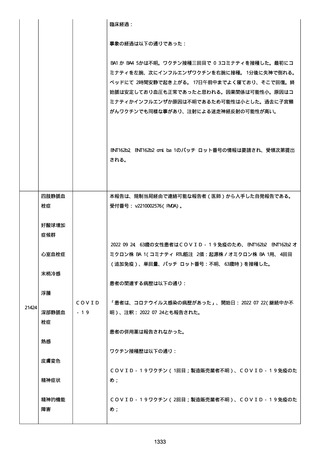
以下)、β-D-グルカン: 12.9 pg/mL(基準値: 20 以下)。
薬剤性間質性肺炎(Grade4)と診断された。
薬剤性間質性肺炎発現時に癌性胸水増悪が認められた。肺転移は不
変、胸膜転移および癌性リンパ管症はなかった。
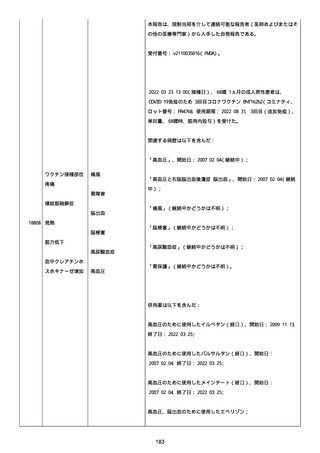
鼻カニュラにて酸素吸入(2L/分)を開始した(2021/07/22 まで)。
人工呼吸器の使用はなかった。
SpO2: 94%(酸素投与下)、脈拍:98、血圧:103/46 mmHg、体温:37.1
度、呼吸数:20。
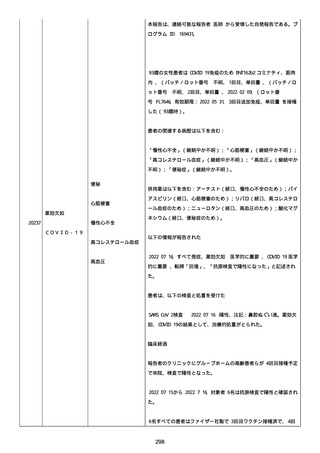
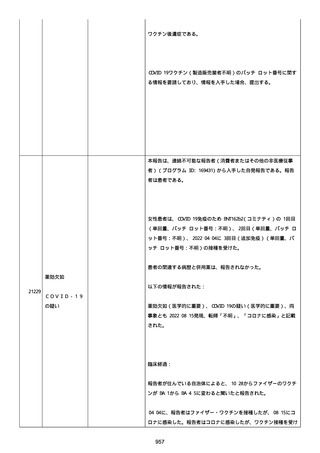
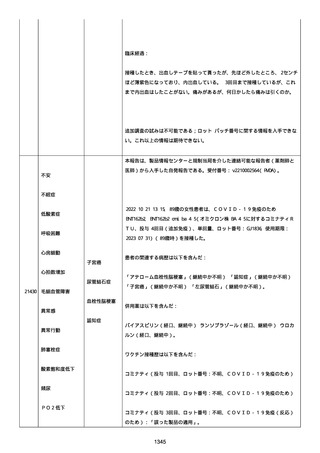
メチルプレドニゾロンコハク酸エステルナトリウム 1000mg、タゾバ
クタムナトリウム・ピペラシリンナトリウム(0.5g、3 回/日)、ス
ルファメトキサゾール・トリメトプリム(2 錠、2 回/日)、アジスロ
マイシン水和物(500mg/日を 3 日間)は投与された。
57