資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
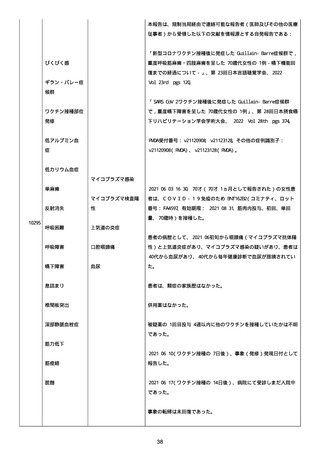
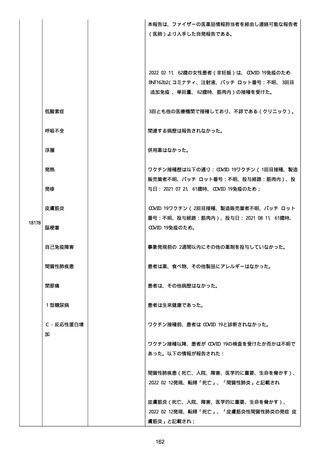
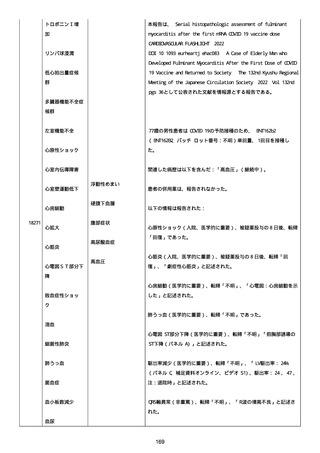
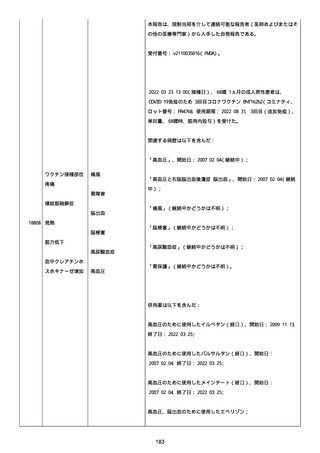
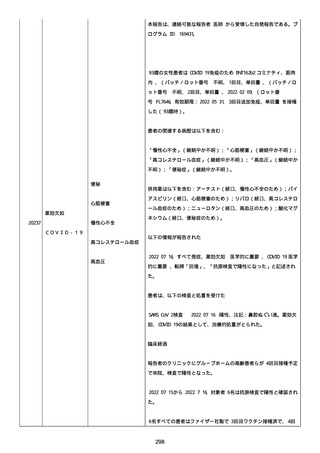
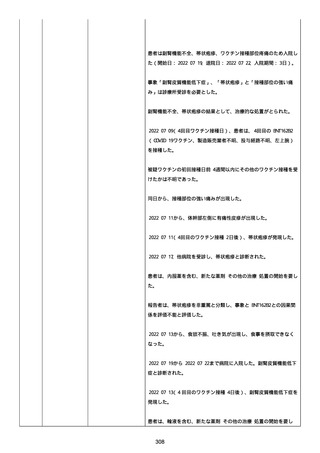
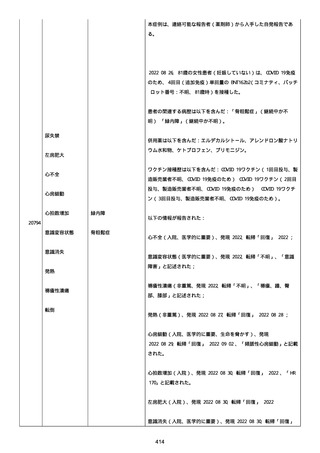
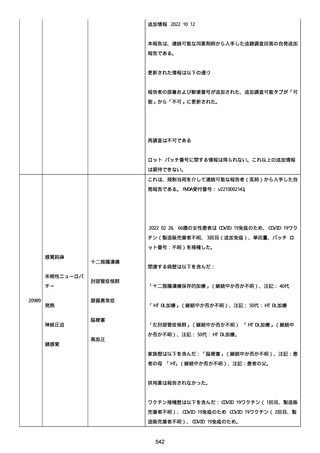
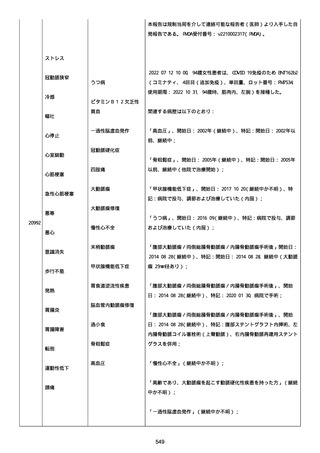
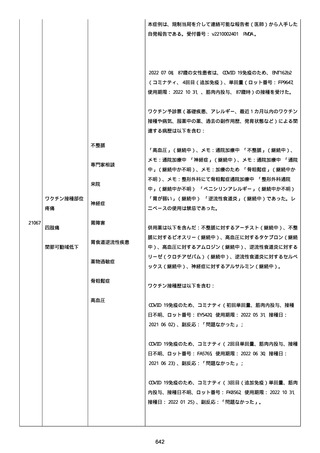
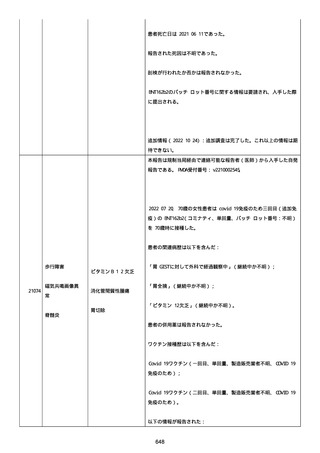
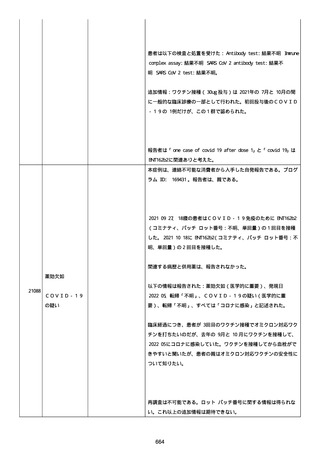
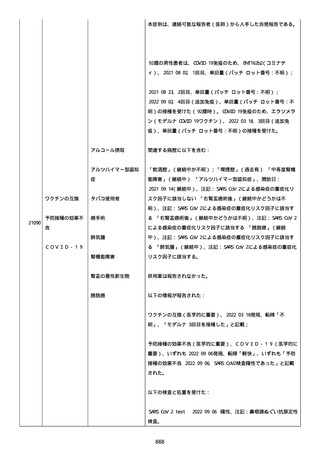
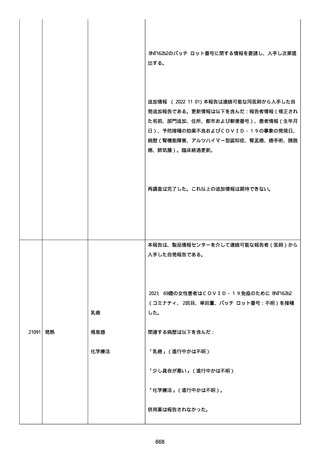
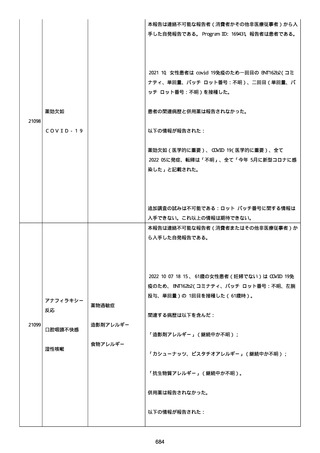
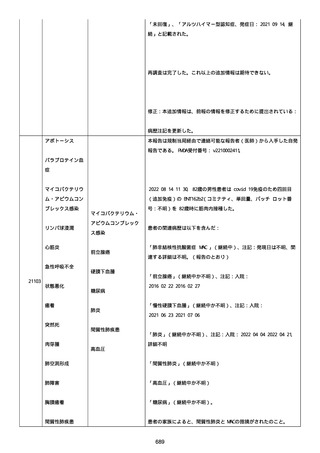
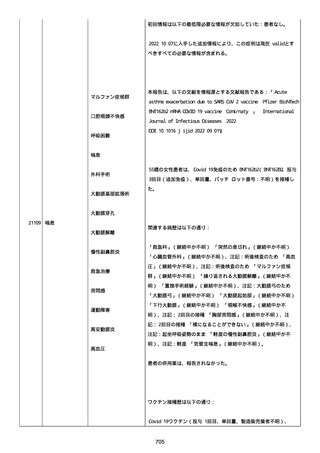
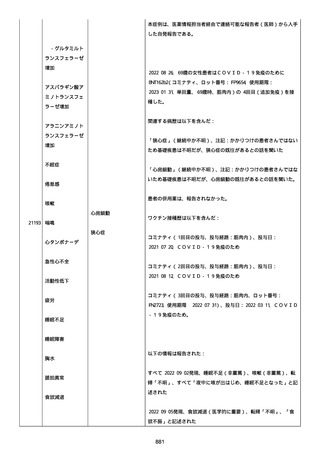
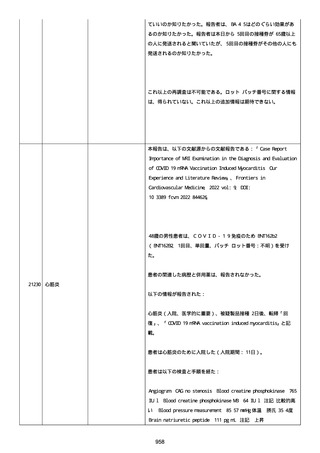
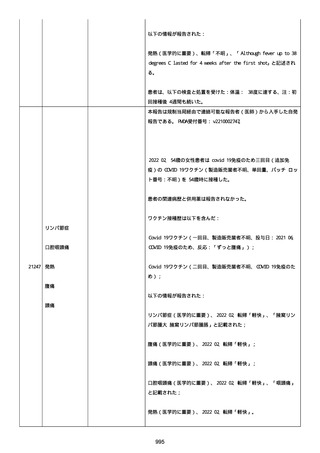
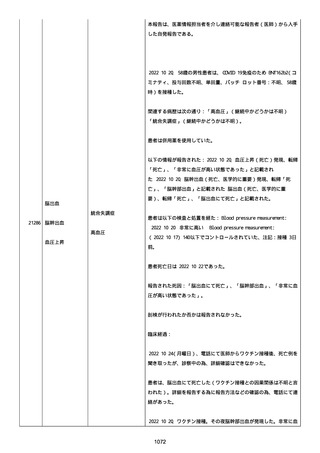
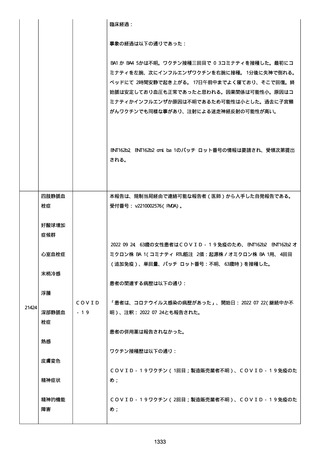
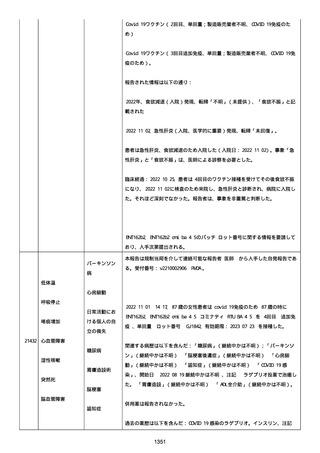
血小板減少症が追加された。臨床検査(血液検査)にて抗血小板グリ
コプロテイン Ilb/Illa 抗体を伴う重症な血小板減少症(1000/mm3 未
満)と、退院から 7 カ月後に重症な血小板減少症が再度見られたこと
が追加された。
血小板減少、上下腕の皮下出血、特発性血小板減少性紫斑病、肺炎、
下血、全身倦怠感、リンパ節腫脹、舌先端に 1cm 程の粘膜下出血/口
腔内出血、四肢に点状紫斑が散在、発熱、鼻出血、黒色便、貧血進行
の転帰は軽快、他の事象の転帰は不明であった。
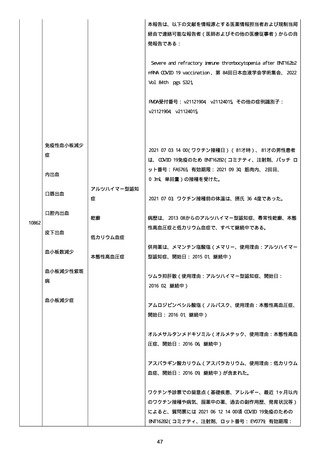
報告者は事象を重篤(入院)と分類し、事象と BNT162b2 との因果関
係を関連ありとした。
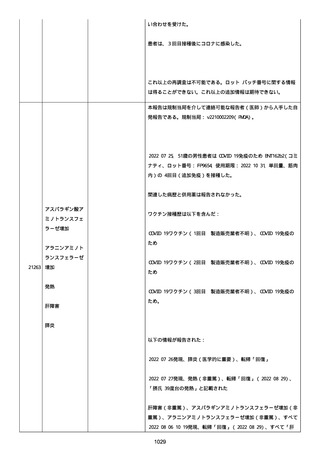
他要因(他の疾患等)、急性特発性血小板減少性紫斑病であった。
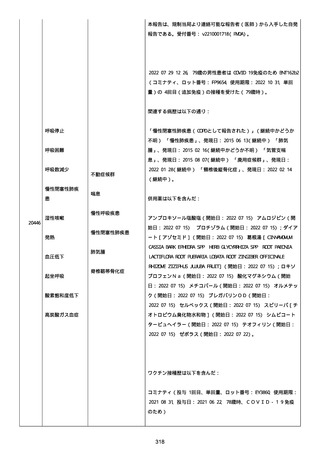
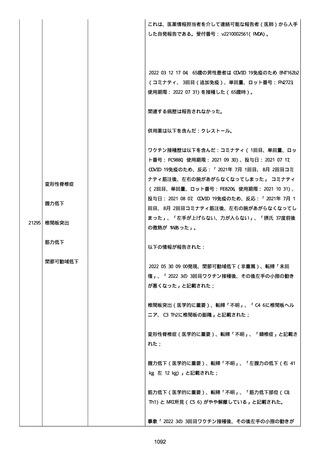
報告者は以下の通りコメントした:
本ワクチン投与後に血小板減少およびその他の症状が認められたこと
から、因果関係が否定できないものと考えている。
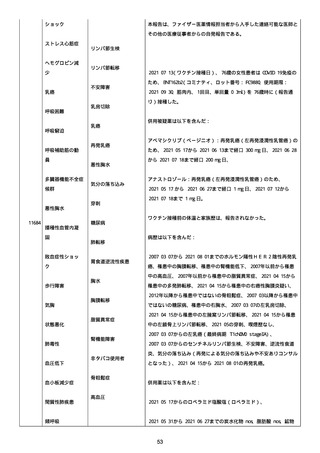
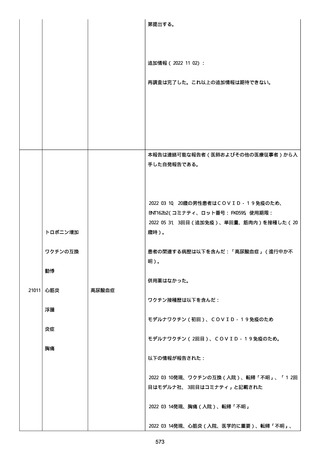
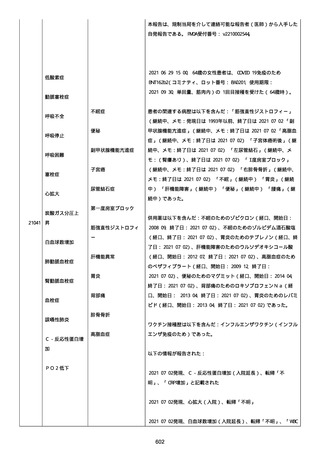
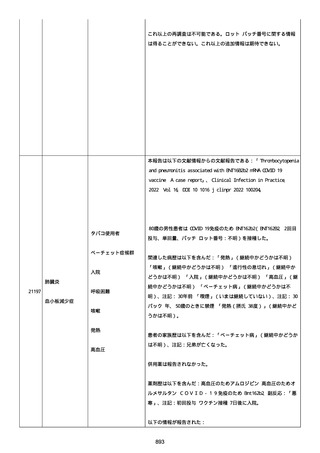
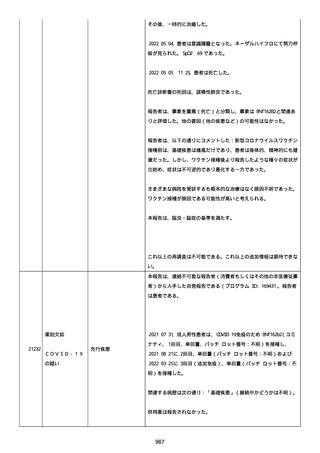
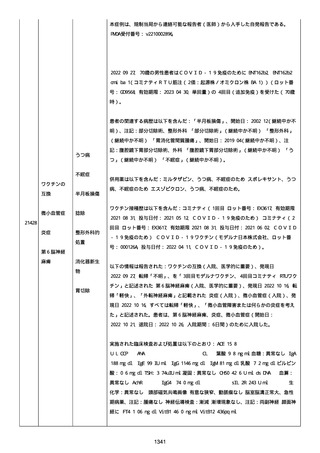
2021 年不詳日、2 回目のワクチン接種を受けた。
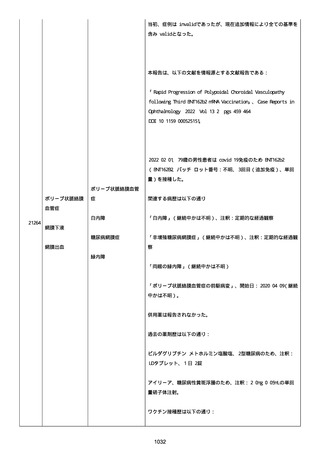
報告者はさらに次のようにコメントした:
特発性血小板減少性紫斑病の治療に準じて薬物療法を実施した。
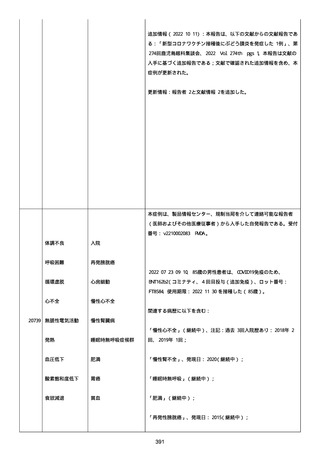
追跡調査は完了され、追加情報は期待できない。
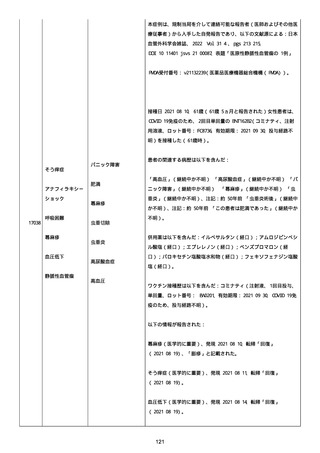
追加情報(2021/07/21):これは重複報告 2021759210 と 2021758588
から情報を統合した追加報告である。これ以降すべての追加情報は
2021759210 にて報告される。新情報は以下の通り:新たな事象(腕
の痛み、両下肢の点状出血、血小板減少性紫斑病)、臨床データ、併
用薬、投与情報、症例詳細。
11