資料1-2-3-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について(コミナティ筋注・集計対象期間における基礎疾患等及び症例経過) (1209 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
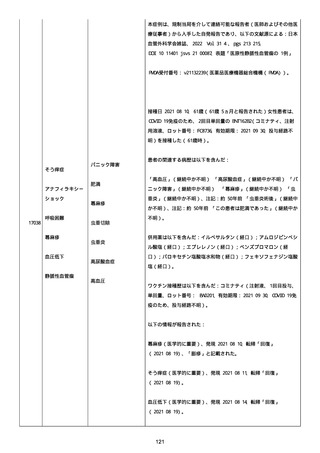
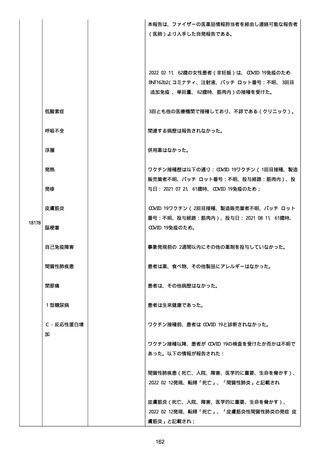
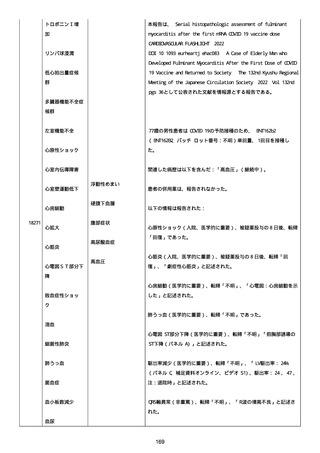
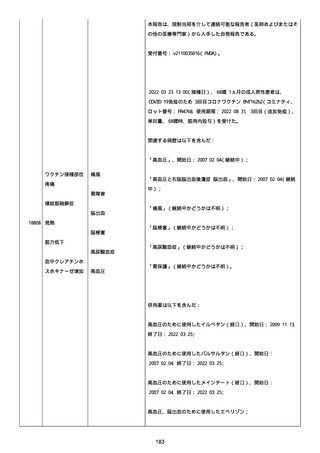
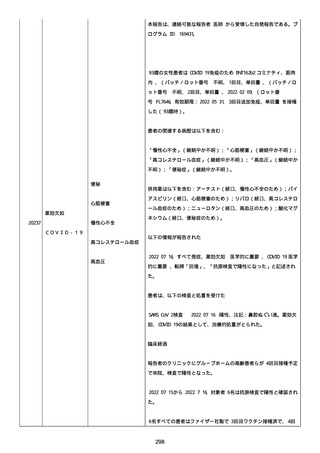
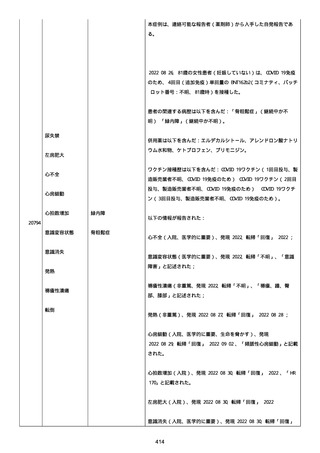
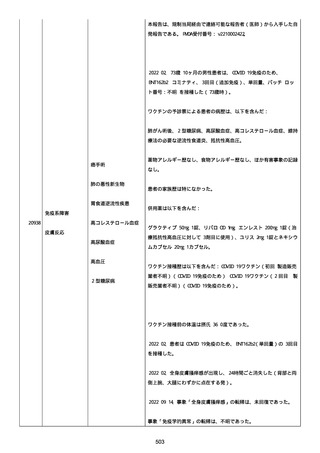
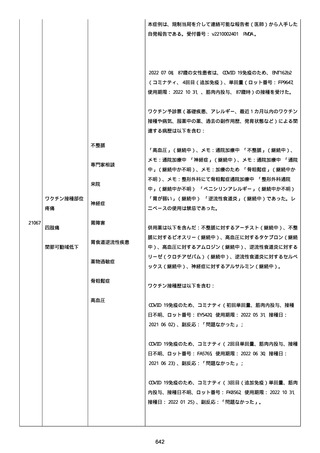
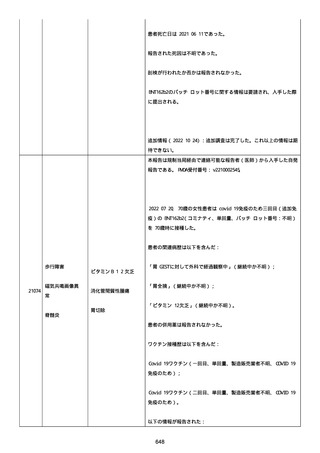
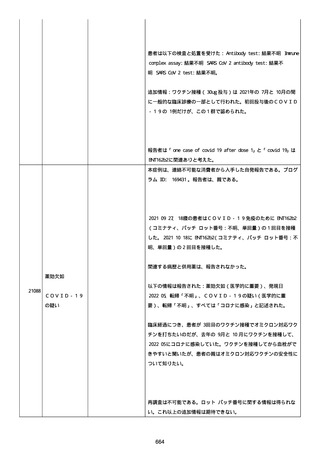
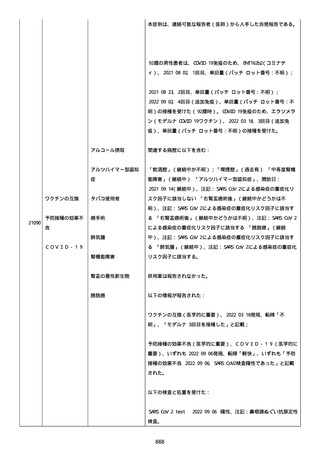
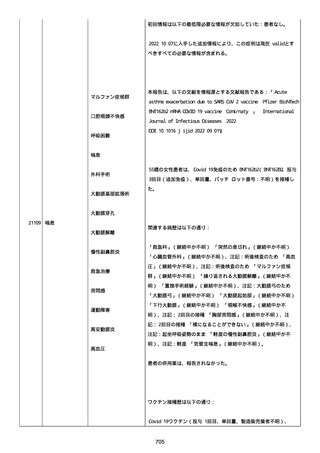
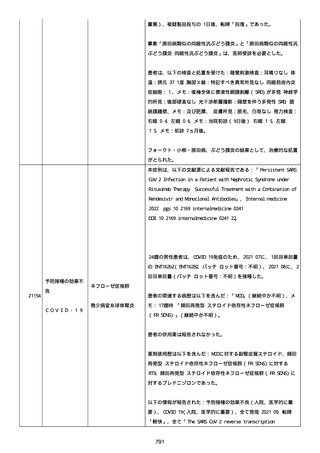
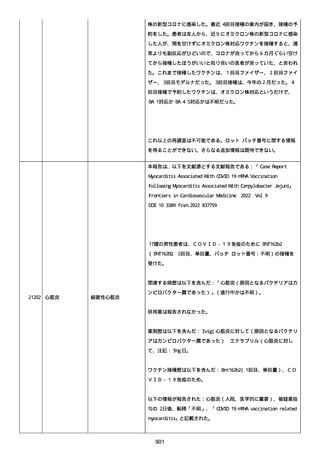
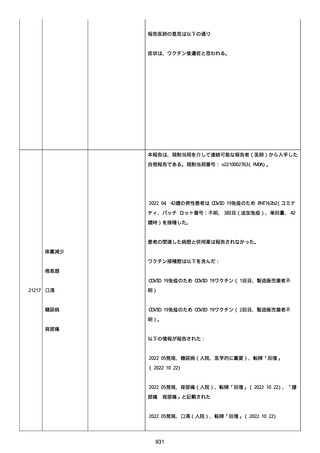
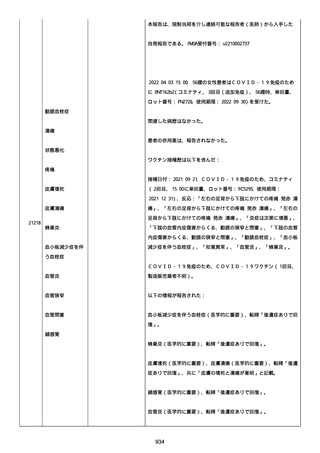
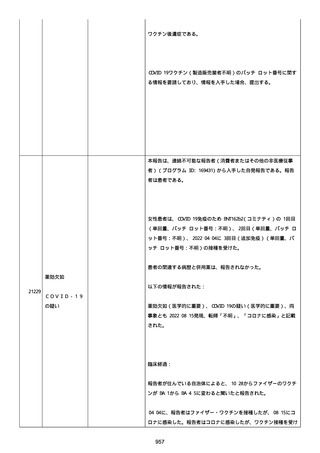
高血圧症を指摘されたことはなく、肝硬変や抗血栓療法など危険因子
はなかった。微小出血、アミロイド血管症、脳動静脈奇形、硬脈動静
脈瘻、海綿状血管腫、脳静脈洞血栓症、出血性脳梗塞、可逆性脳血管
収縮症候群、脳腫瘍、脳膿瘍、脳動脈瘤、もやもや病、原発性中枢神
経系血管炎などの脳MRI/MRA 所見もなかった(up to date)。コロ
ナウイルス修飾ウリジン RNA ワクチンと脳出血の関連が検討されてい
る(Nat Med. 2021;27:2144)。接種から 1 ヶ月以上空いているが mRNA
が DNA へ逆転写される可能性や(Curr lssues MoI BioI.
2022;44:1115)、スパイク蛋白が接種 4 ヶ月以上みられることが報告
される(J Immunol. 2021;207:2405)。
1209